Productos Destacados
-

PMSF BioChemica
A0999 -

IPTG BioChemica
A1008 -

DTT BioChemica
A1101 -

NBT BioChemica
A1243 -

-

0 productos disponibles
Bioquímica de Proteínas
Las proteínas se encuentran en todas las células. Su secuencia está determinada por el código genético. Los genes se traducen en proteínas mediante la llamada expresión génica para que las proteínas adecuadas estén disponibles en el momento oportuno.
Las proteínas están formadas por aminoácidos. Puede encontrar una sección aparte sobre esto aquí:
https://www.itwreagents.com/iberia/es/aminoacidos. Estos aminoácidos están unidos mediante los llamados enlaces peptídicos.
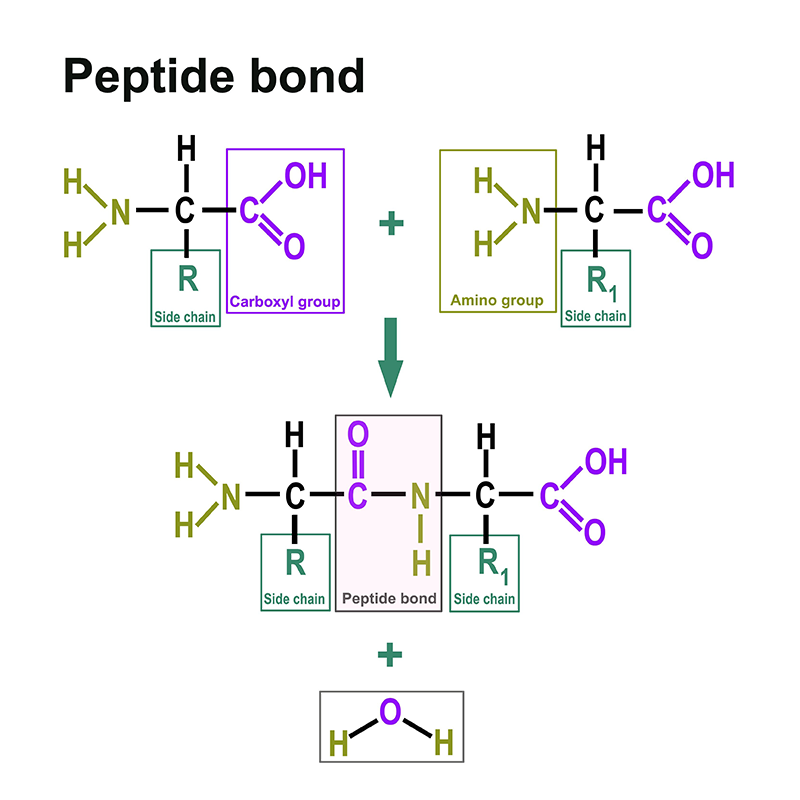
Un enlace peptídico es un enlace ácido carboxílico-amida que conecta dos aminoácidos a través del grupo carboxi de un aminoácido y el grupo amino del otro aminoácido. Suele entenderse como la unión entre los respectivos grupos funcionales en la posición α de dos aminoácidos, es decir, entre el C-1 de un aminoácido y el N-2 del otro aminoácido. El enlace se forma por una reacción de condensación con desprendimiento de agua.
Las múltiples posibilidades de combinación de aminoácidos y péptidos dan lugar a un número casi infinito de estructuras y, por tanto, a muchas funciones. Las proteínas pueden ser enzimas y, por tanto, los catalizadores de la biología. Pueden, por ejemplo, dotar a nuestras células de estructuras, proteger nuestro material genético y mantenerlo empaquetado. Las proteínas desempeñan un papel decisivo en la función motora de nuestro cuerpo y aseguran el movimiento de los músculos en la actina y la miosina. La totalidad de las proteínas de un organismo se denomina proteoma.
Definido de forma más precisa, el proteoma comprende la totalidad de todas las proteínas presentes en una célula o un organismo vivo en condiciones definidas y en un momento determinado. A diferencia del genoma, que es más bien estático, el proteoma y también el transcriptoma son dinámicos y, por tanto, pueden cambiar su composición proteica cualitativa y cuantitativa debido a cambios en las condiciones (factores ambientales, temperatura, expresión génica, administración de fármacos, etc.). La dinámica del proteoma puede visualizarse en el siguiente ejemplo. Una oruga y la mariposa que emerge de ella contienen el mismo genoma, pero sin embargo difieren externamente debido a un proteoma diferente. Lo mismo ocurre con un renacuajo y la rana que se desarrolla a partir de él. Los cambios en el proteoma pueden producirse a veces con gran rapidez, por ejemplo a través de modificaciones postraduccionales como las fosforilaciones y desfosforilaciones de las proteínas, que desempeñan un papel muy importante en el contexto de la transducción de señales.
La proteómica intenta clasificar y catalogar todas las proteínas del organismo y descifrar sus funciones. Los planos de las proteínas se encuentran en el material genético. Mientras que el material genético, el ADN, sólo almacena información, las moléculas de proteínas formadas por aminoácidos cumplen múltiples tareas. Son la sustancia básica de la vida y, por ejemplo, como anticuerpos previenen las enfermedades, y como enzimas permiten el metabolismo y aseguran el movimiento con el esqueleto, los tendones y los músculos.
La palabra proteoma procede del investigador australiano Marc Wilkins y se mencionó por primera vez en una diapositiva de su charla en el congreso „2D Electrophoresis: from protein maps to genomes“, celebrado en Siena el 5 de septiembre de 1994. La redacción de la diapositiva era: “Proteome: the PROTEin complement expressed by a genOME, cell or tissue” (Proteoma: el conjunto de PROTEínas expresado por un genOMA, célula o tejido).
Al igual que la Organización del Genoma Humano (The Human Genome Organisation, HUGO), los investigadores de la Organización Internacional del Proteoma Humano (HUPO) comparten la carga de trabajo en todo el mundo. Alemania se concentra en la investigación de las proteínas del cerebro. En Alemania, los principales científicos especializados en proteínas y proteómica también han unido sus fuerzas en la Sociedad Alemana para la Investigación del Proteoma (DGPF) desde 2001 con el fin de hacer un uso óptimo de las capacidades de investigación.
Subáreas
Las subáreas esenciales son la elucidación de las interacciones proteína-proteína, que dependen principalmente de las estructuras terciarias y cuaternarias de las proteínas y de las interacciones de sus dominios. Además, la purificación de proteínas y el análisis cuantitativo de la expresión de proteínas también pertenecen al campo de la proteómica. Así, complementa los datos obtenidos en el análisis de la expresión génica y proporciona información sobre los componentes de las vías metabólicas y los circuitos de regulación molecular. La ingeniería de proteínas permite modificar las funciones de las proteínas recombinantes para adaptar sus propiedades.
Las técnicas clave de la proteómica apoyan así la elucidación de la función y la estructura tridimensional de las proteínas y la identificación de proteínas individuales en las mezclas.
Dado que todos los procesos metabólicos son llevados a cabo por proteínas, los enfoques terapéuticos, como los nuevos agentes activos contra el cáncer, las infecciones y ciertas enfermedades nerviosas, se basan en ellas. Enfermedades como la anemia de células falciformes, la enfermedad de Alzheimer, la enfermedad de Huntington o la enfermedad de Creutzfeldt-Jakob se basan en proteínas incorrectamente formadas y aglutinadas. Así, si se sabe qué proteína es la responsable de un mal funcionamiento, es posible desarrollar específicamente una pequeña molécula que se acople a esta proteína y evite que siga funcionando mal. En la industria, las proteínas recombinantes se utilizan en forma de enzimas detergentes y pesticidas biológicos. Los biólogos esperan conocer mejor el funcionamiento de los organismos vivos y la vida como tal. Los biofísicos esperan una "anatomía molecular".
Biología de sistemas
Un nuevo campo de investigación que se basa en la proteómica es la biología de sistemas. Ya no se trata de observar las partes individuales de una célula, por ejemplo, sino de describir la interacción de todas las partes individuales dentro de un sistema y su entorno. Además de la proteómica, esto requiere modelos matemáticos que simulen el sistema in silico (es decir, en modelos informáticos), pero también aquellos que permitan reproducirlo en enfoques experimentales.
Paleoproteómica
Además del ADN "antiguo", en ocasiones también se pueden aislar proteínas fósiles de los huesos fósiles, lo que también permite sacar conclusiones sobre su pertenencia a una determinada especie biológica, por ejemplo. La paleoproteómica (del griego παλαιός palaiós, "viejo"), es una disciplina de secuenciación de proteínas procedentes de especímenes antiguos, y se beneficia en particular del hecho de que algunas proteínas son más estables que el ADN durante un período de tiempo más largo. En 2016, por ejemplo, el grupo de investigación de Jean-Jacques Hublin, del Instituto Max Planck de Antropología Evolutiva, pudo aclarar, a partir de muestras de colágeno de unos 40.000 años de antigüedad, que la cultura arqueológica de Châtelperronia está vinculada a los neandertales y no a los humanos anatómicamente modernos (Homo sapiens). En 2019, las proteínas fósiles de la dentina de la mandíbula de Xiahe descubierta en la cueva de Baishiya, en las tierras altas del Tíbet, demostraron que pertenecía a los humanos de Denisova, y unos meses más tarde, las muestras de dentina de 1,9 millones de años confirmaron que el género Gigantopithecus es un taxón "hermano" extinto de los orangutanes. Ya en 2015, los análisis de colágeno revelaron un parentesco más estrecho de los "ungulados sudamericanos" con los ungulados de dedos impares, concretamente Macrauchenia y Toxodon, que todavía estaban presentes en el Pleistoceno tardío. Antes, las relaciones exactas de los "ungulados sudamericanos" con otros grupos de ungulados no estaban claras y eran objeto de debate científico. En el caso del rinoceronte extinto Stephanorhinus, los proteomas que se remontan a unos 200.000 a 400.000 y 1,8 millones de años, respectivamente, en 2017 y 2019, revelaron una relación más estrecha con el rinoceronte lanudo y, por tanto, con un círculo de parentesco más cercano en torno al rinoceronte de Sumatra actual. Esta posición también pudo ser probada por estudios genéticos y anteriormente había sido asumida por motivos anatómicos. También en 2019, los estudios sobre las proteínas contribuyeron a la reclasificación sistemática de los perezosos fósiles y recientes.
En 2015, por ejemplo, atrajo la atención de los medios de comunicación de todo el mundo un estudio de huesos de 80 millones de años de antigüedad del Brachylophosaurus canadensis, un miembro del grupo de los dinosaurios con pico de pato, que reveló péptidos que se interpretaron como restos de vasos sanguíneos debido a su similitud con los péptidos encontrados en aves de corral y avestruces que viven en la actualidad.
Problemas y tendencias
Tras algunas experiencias aleccionadoras con métodos genéticos como el análisis de microarrays, algunos científicos también se muestran algo escépticos con respecto a la investigación del proteoma. Friedrich Lottspeich, del Instituto Max Planck de Bioquímica de Martinsried, presidente de la Sociedad Alemana de Investigación del Proteoma (DGPF), advierte contra las esperanzas exageradas:
"Para el sector humano, la investigación sigue siendo demasiado compleja en este momento de todos modos [...] Pero, por supuesto, nadie quiere gastar dinero en un análisis de la levadura, que sería un buen sistema modelo, de nuevo".
La complejidad se debe a las múltiples posibilidades: Según Friedrich Lottspeich, se calcula que el ser humano tiene entre cientos de miles y millones de proteínas diferentes. Un solo gen produce una media de cinco a diez proteínas, en algunos casos varios cientos. Comprender plenamente esta complejidad es un reto al que los métodos actuales no están aún a la altura. Por otro lado, la investigación del proteoma se está desarrollando rápidamente. Esto se debe, en particular, a la constante mejora de los espectrómetros de masas, que son cada vez más precisos, sensibles y rápidos.
Otro paso importante es el desarrollo de métodos cuantitativos, como los procedimientos SILAC, iTRAQ, TMT o ICAT basados en el uso de isótopos estables, o la codificación de metales MeCAT, en la que se utilizan metales de diferentes pesos para etiquetar proteínas y péptidos de diferentes muestras de proteínas. Este último permite por primera vez en el enfoque multiplex el uso en todo el proteoma de la espectrometría de masas elemental ultrasensible (ICP-MS) (límite de detección en el rango de ppt a ppq inferior), que permite más de 2 a 5 órdenes de magnitud de mayor sensibilidad en la cuantificación de proteínas y tiene un rango de medición dinámico lineal de al menos 6 a 8 órdenes de magnitud. El MeCAT, a diferencia de los otros métodos que "sólo" cuantifican relativamente a nivel de péptidos, permite ventajosamente la cuantificación relativa e incluso absoluta a nivel de proteínas, haciendo que especies proteicas como las proteínas modificadas postraduccionalmente sean más accesibles a la cuantificación. La calibración de la ICP-MS se realiza con estándares metálicos independientes de las proteínas y los péptidos. De este modo, se elimina la necesidad de utilizar péptidos estándar específicos para cada proteína.
Si el análisis cuantitativo del proteoma se combina con otros métodos biológicos, también es posible hacer afirmaciones sobre la función de las proteínas (por ejemplo, la interacción proteína-proteína o las modificaciones postraduccionales). Por tanto, la investigación moderna del proteoma va ahora mucho más allá de la mera catalogación de proteínas e intenta comprender mecanismos complejos.
Aplicaciones sencillas
Para los investigadores y desarrolladores, es importante hacer visibles las proteínas y poder cuantificarlas. Una de las técnicas más importantes para ello es la llamada electroforesis en gel de poliacrilamida (PAGE). En PAGE, las proteínas se separan según su tamaño en un campo eléctrico. Le ofrecemos todo lo que necesita para preparar los geles usted mismo. Encontrará una selección de soluciones de acrilamida y bisacrilamida, APS, TEMED y materiales de apoyo DTT, β-mercaptoetanol, Coomassie y nuestro popular marcador de proteínas.
Las proteínas están siempre predeterminadas en su modo de acción y disponibilidad funcional en los lugares de uso del organismo predeterminados por la evolución. Por lo tanto, como observador desde el exterior, primero hay que poner a disposición las proteínas. Esto ocurre, por un lado, por métodos físicos, como la disrupción celular por calor, o químicos. Por ejemplo, nuestro producto Tritidy G puede ayudar a aislar el ADN, el ARN y las proteínas de una muestra simultáneamente. Sin embargo, los detergentes son especialmente importantes en este contexto. Puede encontrar muchos detergentes conocidos, como el SDS y el Tween, pero también otros más especializados, como la digitonina y la saponina, que suelen utilizarse para las proteínas de membrana. También nos gustaría destacar nuestros productos de sustitución de Triton X-100, que ofrecen una mayor protección a los usuarios.
Productos de sustitución de Triton X-100:
| CÓDIGO DE PRODUCTO | NOMBRE DE PRODUCTO | NÚMERO CAS |
| A9778 | ECOSURF™ EH-9 (alternativa al Triton X-100) |
64366-70-7 |
| A9779 | ECOSURF™ SA-9 (alternativa al Triton X-100) |
|
| A9780 | TERGITOL™ 15-S-9 (alternativa al Triton X-100 ) |
68131-40-8 |
El original, Triton X-100, ha sido clasificado como sustancia de alto riesgo debido al reglamento REACH y ya no se puede adquirir tan fácilmente.
Las técnicas de la bioquímica de proteínas no sólo se utilizan para determinar los estados naturales de las proteínas, sino también para producir las proteínas deseadas mediante manipulaciones dirigidas. Para ello se utilizan los llamados sistemas de expresión. Uno de los más conocidos es el lac-operón. Aquí, los genes de ciertas proteínas se ensamblan por biología molecular utilizando este operón. En las bacterias (E. coli), el organismo produce entonces las proteínas. Todo el proceso es inducido por la sustancia isopropil-β-D-tiogalactopiranósido (IPTG). Tenemos una selección de IPTG disponible para nuestros clientes.
| CÓDIGO DE PRODUCTO | NOMBRE DE PRODUCTO | NÚMERO CAS |
| A1008 | IPTG BioChemica | 367-93-1 |
| A4773 | IPTG para biología molecular, libre de dioxano | 367-93-1 |
| A7211 | IPTG de galactosa de origen vegetal, libre de dioxano | 367-93-1 |
El mayor oponente de una proteína es... otra proteína. La degradación es catalizada por las proteasas. Se encuentran en todos los organismos y, por tanto, a menudo también en las muestras de los usuarios/científicos. Dado que a menudo no sería rentable lograr una separación directa, se utilizan los llamados inhibidores. Estos interfieren con la actividad catalítica de las proteasas para que no puedan activarse y otras enzimas permanezcan intactas.
Sin embargo, a veces lo que se desea es precisamente la degradación de las proteínas, por ejemplo, si sólo se quieren examinar los ácidos nucleicos de una muestra. Las proteínas pueden entonces interferir. Un ejemplo bien conocido podría ser el de ciertos kits de pruebas para COVID-19. La proteinasa K es una proteasa que cataliza la degradación de las proteínas. Ofrecemos proteinasa K de alta calidad en forma liofilizada y ya disuelta lista para usar.
Otros productos importantes que se utilizan son las albúminas y los cofactores como el NAD y el NADPH. Pueden ser necesarios como estabilizadores o como coenzimas en diversas reacciones.
El campo de la proteómica seguirá siendo apasionante durante mucho tiempo. Nos muestra el estado real de cada célula. Muchos ensayos seguirán conduciendo a algunos descubrimientos innovadores.
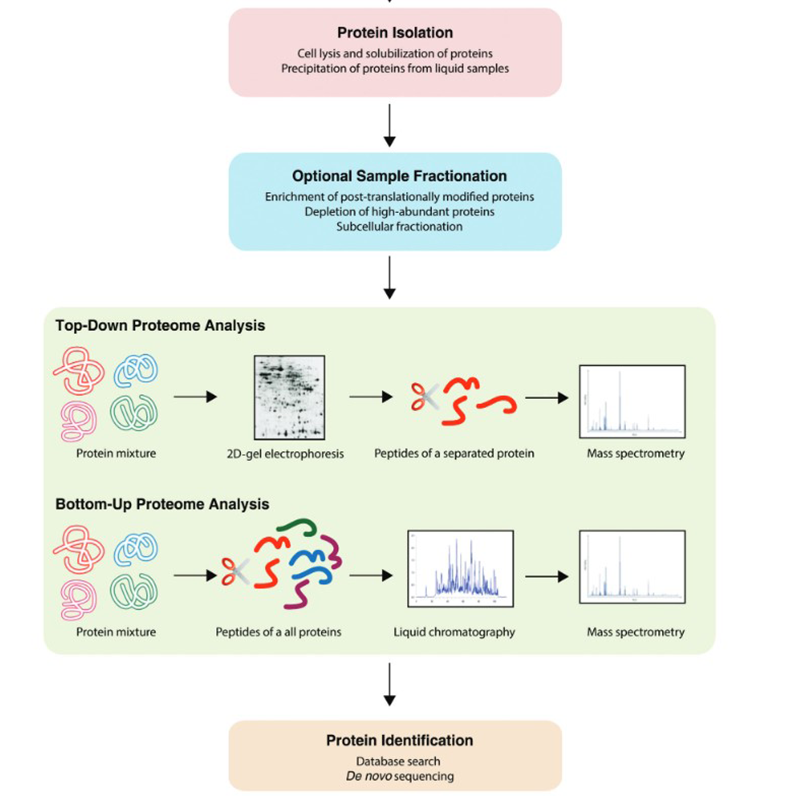
Además de las técnicas ya mencionadas, en el campo de la proteómica se pueden encontrar diversos flujos de trabajo. Pueden tener lugar de abajo a arriba o de arriba a abajo:
.png)
La proteómica también se lleva a cabo a través de modelos en los que se utilizan modelos celulares o animales. La electroforesis en gel 2D y el etiquetado juegan un papel importante. Los principales pasos en el campo de la proteómica se han realizado mediante métodos cromatográficos acoplados a la espectrometría de masas. Para ello, en nuestra gama encontrará los disolventes habituales.
Los métodos que se utilizan habitualmente en la proteómica hoy en día incluyen la cromatografía, la espectrometría de masas, la obtención de imágenes MALDI, la electroforesis de poliacrilamida unidimensional (1D PAGE), la electroforesis en gel de poliacrilamida bidimensional (2D PAGE), los microarrays, el análisis de aminoácidos (AAA), el cultivo celular y, sobre todo, un amplio uso de modelos bioinformáticos.
Especialmente en el diagnóstico de tumores, la proteómica cualitativa y cuantitativa se utiliza y permite sacar conclusiones para el pronóstico y las terapias de cada paciente.
Las proteínas también son de gran importancia en la inmunología. Nuestros anticuerpos también son formas especiales de proteínas.
La complejidad de la proteómica se debe a las múltiples posibilidades que ofrece: Según Friedrich Lottspeich (bioquímico austriaco), se calcula que el ser humano tiene entre cientos de miles y millones de proteínas diferentes. Un solo gen produce una media de cinco a diez proteínas, en algunos casos varios cientos. Comprender plenamente esta complejidad es un reto al que los métodos actuales no están aún a la altura. Por otro lado, la investigación del proteoma se está desarrollando rápidamente. Esto se debe, en particular, a la constante mejora de los espectrómetros de masas, que son cada vez más precisos, sensibles y rápidos.
A continuación se ofrece un resumen de artículos importantes para el estudio de la bioquímica de las proteínas (proteómica):
| CÓDIGO DE PRODUCTO | NOMBRE DE PRODUCTO | NÚMERO CAS |
| A1088 | ABTS BioChemica | 30931-67-0 |
| A4983 | Acrilamida solución (30%) - Mezcla 29 : 1 para biología molecular | |
| A3626 | Acrilamida solución (30%) - Mezcla 37,5 : 1 para biología molecular | |
| A3658 | Acrilamida solución (40%) - Mezcla 19 : 1 para biología molecular | |
| A0385 | Acrilamida solución (40%) - Mezcla 29 : 1 para biología molecular | |
| A4989 | Acrilamida solución (40%) - Mezcla 37,5 : 1 para biología molecular | |
| A7582 | Acrilamida 2K solución (18%) para desnaturalizar el ADN-PAGE | |
| A7590 | Acrilamida 2K solución (8 %) para desnaturalizar el ADN-PAGE | |
| A1089 | Acrilamida 2K standard grade, puro | 79-06-1 |
| A0951 | Acrilamida 4K solución (30%) - Mezcla 29 : 1 | |
| A1672 | Acrilamida 4K solución (30%) - Mezcla 37,5 : 1 | |
| A1577 | Acrilamida 4K solución (40%) - Mezcla 37,5 : 1 | |
| A1090 | Acrilamida 4K ultrapuro | 79-06-1 |
| A1421 | AEBSF Clorhidrato BioChemica | 30827-99-7 |
| A0850 | Albúmina para EIA y RIA | 9048-46-8 |
| A2244 | Albúmina Fracción V (pH 5,2) | 9048-46-8 |
| A1391 | Albúmina Fracción V (pH 7,0) | 9048-46-8 |
| A6588 | Albúmina Fracción V (pH 7,0) para Western blotting | 9048-46-8 |
| A4344 | Albúmina cruda de clara de huevo | 9006-59-1 |
| A1523 | 4-Aminoantipirina BioChemica | 83-07-8 |
| A7708 | AppliCoat Plate Stabilizer BioChemica | |
| A2132 | Aprotinina BioChemica | 9087-70-1 |
| A2568 | Avidina BioChemica | 1405-69-2 |
| A1117 | BCIP BioChemica | 6578-06-9 |
| A3636 | Bisacrilamida para biología molecular | 110-26-9 |
| A3417 | CheLuminate-HRP PicoDetect | |
| A1101 | DTT BioChemica | 3483-12-3 |
| A2948 | DTT para biología molecular | 3483-12-3 |
| A3668 | DTT 1 mol/L (1 M) para biología molecular | 3483-12-3 |
| A1495 | Estreptavidina ultrapuro | 9013-20-1 |
| A1007 | X-Gal BioChemica | 7240-90-6 |
| A4978 | X-Gal para biología molecular | 7240-90-6 |
| A2243 | L-Glutatión oxidado BioChemica | 27025-41-8 |
| A9782 | L-Glutatión reducido (USP) puro, grado farma | 70-18-8 |
| A2084 | L-Glutatión reducido BioChemica | 70-18-8 |
| A1828 | Inhibidor de tripsina de soja > 7000 BAEE | 9035-81-8 |
| A1008 | IPTG BioChemica | 367-93-1 |
| A4773 | IPTG para biología molecular, libre de dioxano | 367-93-1 |
| A7211 | IPTG de galactosa de origen vegetal, libre de dioxano | 367-93-1 |
| A0830 | Leche deshidratada sin grasa, polvo | |
| A2185 | Luminol | 521-31-3 |
| A1108 | β-Mercaptoetanol para biología molecular | 60-24-2 |
| A1243 | NBT BioChemica | 298-83-9 |
| A1272 | 2-Nitrofenil-β-D-Galactopiranósido BioChemica | 369-07-3 |
| A1028 | 4-Nitrofenil β-D-Glucurónido BioChemica | 10344-94-2 |
| A2205 | Pepstatina A | 26305-03-3 |
| A0999 | PMSF BioChemica | 329-98-6 |
| A2935 | Ponceau S - Solución | |
| A8889 | Protein Marker VI (10 – 245) prestained | |
| A2144 | Quimostatina | 9076-44-2 |
| A3840 | 3,3',5,5'-Tetrametilbencidina BioChemica | 54827-17-7 |
| A1148 | TEMED | 110-18-9 |