Ausgewählte Produkte
-

PMSF BioChemica
A0999 -

IPTG BioChemica
A1008 -

DTT BioChemica
A1101 -

NBT BioChemica
A1243 -

-

107 Produkte verfügbar
- 2-Nitrophenyl-β-D-galactopyranosid BioChemica A1272,0025 · 369-07-3
- 3,3',5,5'-Tetramethylbenzidin BioChemica A3840,0025 · 54827-17-7
- ABTS BioChemica A1088,0010 · 30931-67-0
- ABTS BioChemica A1088,0005 · 30931-67-0
- Acrylamid - Lösung (30 %) - Mix 29 : 1 für die MolekularbiologieA4983,0500 ·
- Acrylamid - Lösung (30 %) - Mix 37,5 : 1 für die MolekularbiologieA3626,0500 ·
- Acrylamid - Lösung (30 %) - Mix 37,5 : 1 für die MolekularbiologieA3626,1000 ·
- Acrylamid - Lösung (40 %) - Mix 19 : 1 für die MolekularbiologieA3658,1000 ·
- Acrylamid - Lösung (40 %) - Mix 37,5 : 1 für die MolekularbiologieA4989,0500 ·
- Acrylamid - Lösung (40 %)-Mix 29 : 1 für die MolekularbiologieA0385,1000 ·
- Acrylamid - Lösung (40 %)-Mix 29 : 1 für die MolekularbiologieA0385,0500 ·
- Acrylamid 2K - Lösung (18 %) zur Denaturierung von DNA-PAGEA7582,9010 ·
- Acrylamid 2K - Lösung (8 %) für die denaturierende DNA-PAGEA7590,9010 ·
- Acrylamid 2K Standardpräparat, extrapure A1089,0500 · 79-06-1
- Acrylamid 4K - Lösung (30%) - Mix 29 : 1 A0951,1000 ·
Proteinbiochemie
Proteine finden sich in jeder Zelle. Ihre Sequenz wird bereits durch den genetischen Code abgebildet. Gene werden im Zuge der sogenannten Expression abgelesen, damit die richtigen Proteine, zur richtigen Zeit im Lebewesen zur Verfügung stehen.
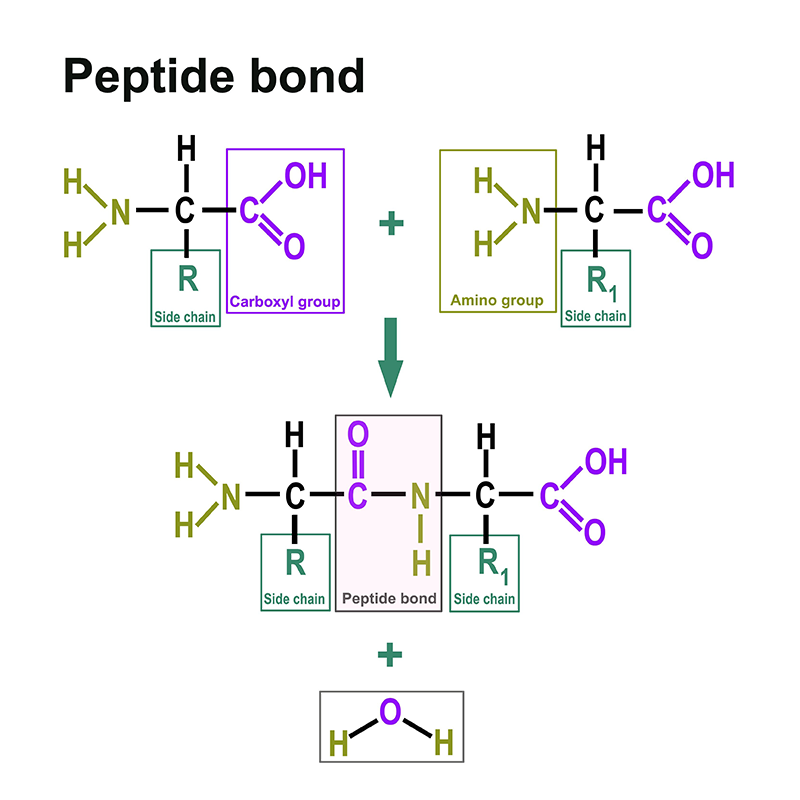
Proteine bestehen aus Aminosäuren. Dazu finden sind hier: https://www.itwreagents.com/germany/de/aminosaeuren eine eigene Rubrik. Diese Aminosäuren sind verknüpft über sogenannte Peptidbindungen.
Eine Peptidbindung ist eine Carbonsäure-Amid-Bindung, die zwei Aminosäuren über die Carboxygruppe der einen Aminosäure und die Aminogruppe der anderen Aminosäure verbindet. Meistens versteht man darunter die Bindung zwischen den jeweils funktionellen Gruppen in α-Position zweier Aminosäuren, d. h. zwischen dem C-1 der einen Aminosäure und dem N-2 der anderen Aminosäure. Die Bindung entsteht durch eine Kondensationsreaktion unter Wasserabspaltung.
Die vielfache Kombinationsmöglichkeit der Aminosäuren und auch von Peptiden führt zu einer schier unendlichen Möglichkeit an Strukturen und damit zu vielen Funktionen. Proteine können Enzyme sein und damit die Katalysatoren der Biologie. Sie können beispielsweise unseren Zellen Strukturen geben, unser Erbgut schützen und verpackt halten. Bei unsererer Körpermotorik spielen Proteine eine Entscheidende Rolle und Sorgen im Aktin und Myosin für die Bewegung der Muskulatur. Die Gesamtheit der Proteine eines Organismus wird Proteom genannt.
Genauer definiert umfasst das Proteom die Gesamtheit aller in einer Zelle oder einem Lebewesen unter definierten Bedingungen und zu einem definierten Zeitpunkt vorliegenden Proteine. Das Proteom und auch das Transkriptom sind im Gegensatz zum eher statischen Genom dynamisch und können sich daher in ihrer qualitativen und quantitativen Proteinzusammensetzung aufgrund veränderter Bedingungen (Umweltfaktoren, Temperatur, Genexpression, Wirkstoffgabe etc.) verändern. Sehr bildlich kann man sich die Dynamik des Proteoms an folgendem Beispiel vor Augen führen. Eine Raupe und der aus ihr entstehende Schmetterling enthalten das gleiche Genom, unterscheiden sich aber trotzdem äußerlich aufgrund eines unterschiedlichen Proteoms. Dasselbe gilt auch für eine Kaulquappe und den daraus entstehenden Frosch. Die Veränderungen des Proteoms können zum Teil sehr schnell erfolgen, beispielsweise durch posttranslationale Modifikationen wie die Phosphorylierungen und Dephosphorylierung von Proteinen, die im Rahmen der Signaltransduktion eine sehr wichtige Rolle spielen.
Die Proteomik versucht, sämtliche Proteine im Organismus einzuordnen, zu katalogisieren und ihre Funktionen zu entschlüsseln. Die Baupläne der Proteine finden sich in den Erbanlagen. Speichert die Erbsubstanz DNA lediglich Informationen, so erfüllen die aus Aminosäuren bestehenden Eiweißmoleküle vielfache Aufgaben. Sie sind Grundsubstanz des Lebens und wehren z. B. als Antikörper Krankheiten ab, und ermöglichen als Enzyme unter anderem den Metabolismus und sorgen mit Skelett, Sehnen und Muskeln für Bewegung.
Das Wort Proteom stammt vom australischen Forscher Marc Wilkins und wurde auf einem Dia in seinem Vortrag auf dem Kongress 2D Electrophoresis: from protein maps to genomes, am 5. September 1994 in Siena zum ersten Mal erwähnt. Der Wortlaut auf dem Dia lautete: “Proteome: the PROTEin complement expressed by a genOME, cell or tissue.” (deutsch: „Proteom: das PROTEinkomplement, das vom GenOM einer Zelle oder eines Gewebes exprimiert ist“).
Ähnlich wie die Human Genome Organisation (HUGO) teilen sich die Forscher der Internationalen Humanproteom-Organisation (HUPO) weltweit die anfallende Arbeit. Deutschland konzentriert sich dabei auf die Erforschung der Gehirnproteine. In Deutschland haben sich seit 2001 führende Protein- und Proteomikwissenschaftler zudem in der Deutschen Gesellschaft für Proteomforschung (DGPF) zusammengeschlossen, um die Forschungskapazitäten optimal zu nutzen.
Teilgebiete
Wesentliche Teilgebiete sind die Aufklärung von Protein-Protein-Interaktionen, die vor allem von Tertiär- und Quartärstrukturen der Proteine und den Wechselwirkungen ihrer Domänen abhängen. Weiterhin gehört auch die Proteinreinigung und die quantitative Analyse der Proteinexpression in den Bereich der Proteomik. Sie ergänzt somit die Daten, die in der Genexpressionsanalyse gewonnen werden und gibt Aufschluss über die Komponenten von Stoffwechselwegen und molekularen Regelkreisen. Das Protein-Engineering erlaubt die Veränderung von Funktionen rekombinanter Proteine zur Anpassung seiner Eigenschaften.
Die Schlüsseltechniken der Proteomik unterstützen also die Aufklärung der Funktion und der 3-D-Proteinstruktur und die Identifikation einzelner Proteine in Gemischen.
Da alle metabolischen Prozesse durch Proteine erfolgen, basieren Therapieansätze wie neue Wirkstoffe gegen Krebs, Infektionen und bestimmte Nervenkrankheiten darauf. Leiden wie Sichelzellanämie, Alzheimer-Krankheit, Chorea Huntington oder die Creutzfeldt-Jakob-Krankheit beruhen auf fehlerhaft geformten und verklumpenden Proteinen. Ist also bekannt, welches Protein für eine Fehlfunktion verantwortlich ist, so ist es möglich, gezielt ein kleines Molekül zu entwickeln, welches an dieses Protein andockt und eine weitere Fehlfunktion verhindert. In der Industrie werden rekombinante Proteine in Form von Waschmittelenzymen und biologischen Pflanzenschutzmitteln verwendet. Biologen erhoffen sich bessere Einblicke in die Funktionsweise von Lebewesen und das Leben als solches. Die Biophysiker erwarten eine „molekulare Anatomie“.
Systembiologie
Ein neues Forschungsgebiet, das auf der Proteomik aufbaut, ist die Systembiologie. Diese versucht nicht mehr allein die einzelnen Teile z. B. einer Zelle zu betrachten, sondern versucht das Zusammenwirken aller Einzelteile innerhalb eines Systems und seiner Umgebung zu beschreiben. Dazu erforderlich sind neben der Proteomik v. a. mathematische Modelle, die das System in silico (d. h. in Computermodellen) simulieren aber auch solche, die es erlauben dies in experimentellen Ansätzen nachzustellen.
Paläoproteomik
Aus fossilen Knochen können neben „alter“ DNA gelegentlich auch fossile Proteine isoliert werden, die ebenfalls z. B. Rückschlüsse auf deren Zugehörigkeit zu einer bestimmten biologischen Art ermöglichen. Der hierauf aufbauenden Paläoproteomik (von griechisch παλαιός palaiós, „alt“) kommt insbesondere zugute, dass einige Proteine längere Zeit stabiler sind als DNA. So konnte 2016 durch die Arbeitsgruppe von Jean-Jacques Hublin vom Max-Planck-Institut für evolutionäre Anthropologie anhand von rund 40.000 Jahre alten Kollagen-Proben geklärt werden, dass die archäologische Kultur des Châtelperronien mit den Neandertalern verbunden ist und nicht mit dem anatomisch modernen Menschen (Homo sapiens). 2019 wurde anhand fossiler Proteine aus Dentin des im Hochland von Tibet in der Baishiya-Höhle entdeckten Xiahe-Unterkiefers nachgewiesen, dass er den Denisova-Menschen zuzurechnen ist, und einige Monate später bestätigten 1,9 Millionen Jahre alte Dentin-Proben, dass die Gattung Gigantopithecus ein ausgestorbenes „Schwester“-Taxon der Orang-Utans ist. Bereits im Jahr 2015 erbrachten Kollagenanalysen eine nähere Verwandtschaft der „Südamerikanischen Huftiere“ mit den Unpaarhufern, namentlich untersucht wurden Macrauchenia und Toxodon, die noch im ausgehenden Pleistozän vorkamen. Zuvor waren die genauen Verwandtschaftsverhältnisse der „Südamerikanischen Huftiere“ zu anderen Huftiergruppen unklar gewesen und Gegenstand wissenschaftlicher Debatten. Für den ausgestorbenen Nashornvertreter Stephanorhinus ergaben sich in den Jahren 2017 und 2019 anhand von rund 200.000 bis 400.000 beziehungsweise 1,8 Millionen Jahre alten Proteomen eine nähere Beziehung zum Wollnashorn und damit zu einem engeren Verwandtschaftskreis um das heutige Sumatra-Nashorn. Die Stellung ließ sich auch durch genetische Studien belegen und war zuvor aus anatomischen Gründen angenommen worden. Ebenfalls 2019 trugen Studien an Proteinen zur systematischen Neugliederung der fossilen und rezenten Faultiere bei.
Weltweite mediale Beachtung fand 2015 beispielsweise eine Studie an 80 Millionen Jahre alten Knochen des zur Gruppe der Entenschnabelsaurier gehörigen Brachylophosaurus canadensis, in der Peptide nachgewiesen wurden, die aufgrund ihrer Ähnlichkeit mit Peptiden heute lebender Hühnervögel und Strauße, als Überreste von Blutgefäßen interpretiert wurden.
Probleme und Trends
Nach zum Teil ernüchternden Erfahrungen mit genetischen Methoden wie der Microarray-Analyse herrscht bei einigen Wissenschaftlern auch bezüglich der Proteomforschung eine gewisse Skepsis vor. Friedrich Lottspeich vom Max-Planck-Institut für Biochemie in Martinsried, Präsident der Deutschen Gesellschaft für Proteomforschung (DGPF), warnt vor überzogenen Hoffnungen:
„Für den Humanbereich ist die Forschung derzeit eigentlich sowieso noch zu komplex […] Aber für eine Analyse der Hefe, die ein gutes Modellsystem wäre, will natürlich wieder keiner Geld ausgeben.“
Die Komplexität ergibt sich aus den vielen Möglichkeiten: Laut Friedrich Lottspeich hat der Mensch schätzungsweise mehrere hunderttausend bis Millionen verschiedene Proteine. Ein einzelnes Gen produziert im Schnitt fünf bis zehn Proteine, in manchen Fällen mehrere hundert. Diese Komplexität vollständig zu erfassen ist eine Herausforderung, der die derzeitigen Methoden noch nicht gewachsen sind. Auf der anderen Seite entwickelt sich die Proteomforschung rasant weiter. Das ist insbesondere auf eine ständige Verbesserung der Massenspektrometer zurückzuführen, die immer präziser, sensitiver und schneller werden.
Ein weiterer wichtiger Schritt ist die Entwicklung quantitativer Methoden, wie die auf dem Einsatz stabiler Isotope basierenden SILAC, iTRAQ, TMT oder ICAT Verfahren oder der MeCAT-Metallkodierung, bei der unterschiedlich schwere Metalle zur Markierung von Proteinen und Peptiden aus verschiedenen Proteinproben eingesetzt werden. Letztere erlaubt erstmals im Multiplexansatz den proteomweiten Einsatz der ultrasensitiven Elementmassenspektrometrie (ICP-MS) (Nachweisgrenze im ppt bis unteren ppq Bereich), die eine über 2 bis 5 Größenordnungen höhere Sensitivität bei der Proteinquantifizierung erlaubt und einen linearen dynamischen Messbereich von mindestens 6 bis 8 Größenordnungen aufweist. MeCAT erlaubt im Gegensatz zu den anderen Verfahren, die auf Peptidebene 'nur' relativ quantifizieren, vorteilhafterweise eine relative und sogar absolute Quantifizierung auf Proteinebene, wodurch Proteinspezies wie posttranslational modifizierte Proteine einer Quantifizierung besser zugänglich werden. Die Kalibrierung der ICP-MS erfolgt mit protein-/peptidunabhängigen Metallstandards. Die Notwendigkeit proteinspezifischer Standardpeptide entfällt somit.
Kombiniert man quantitative Proteomanalyse mit anderen biologischen Methoden, so kann man auch Aussagen über die Funktion von Proteinen treffen (z. B. Protein-Protein-Interaktion oder Posttranslationale Modifikationen). Die moderne Proteomforschung geht daher inzwischen weit über das bloße Katalogisieren von Proteinen hinaus und versucht komplexe Mechanismen zu verstehen.
Einfache Anwendungen
Für Forscher und Entwickler ist es wichtig Proteine sichtbar zu machen und sie quantifizieren zu können. Eine der wichtigsten Techniken dazu ist die sogenannte Polyacrylamidgelelektrophorese (PAGE). Bei der PAGE werden die Proteine ihrer Größe nach in einem elektrischen Feld aufgetrennt. Wir bieten dazu alles, um die Gele selbst herstellen zu können. Sie finden eine Auswahl an Acrylamid- und Bisacrylamidlösungen, APS, TEMED und unterstützenden Materialien DTT, β-Mercaptoethanol, Coomassie und unseren beliebten Proteinmarker.
Proteine sind in ihrer Wirkweise und funktionellen Verfügbarkeit immer an durch die Evolution vorgegebenen Einsatzorte im Organismus vorbestimmt. Daher muss man sich die Proteine als Betrachter von außen erst verfügbar machen. Dies passiert zum einen durch physikalische Methoden, wie Zellaufschluss durch Hitze oder chemisch. Z.B. kann unser Produkt Tritidy G helfen DNA, RNA und Proteine aus einer Probe gleichzeitig zu isolieren. Besonders wichtig in diesem Zusammenhang sind jedoch vor allem Detergenzien. Viele sehr bekannte Detergenzien wie SDS und Tween können sie bei uns finden, aber auch speziellere wie Digitonin und Saponin, die gerne für Membranproteine eingesetzt werden. Wir weisen an dieser Stelle auch gerne auf unsere Triton X-100 Ersatzprodukte hin, welche einen größeren Schutz für die Anwender bieten.
Triton X-100 Ersatzprodukte:
| PRODUKTCODE | PRODUKTNAME | CAS NUMMER |
| A9778 | ECOSURF™ EH-9 (Triton X-100 Ersatzartikel) |
64366-70-7 |
| A9779 | ECOSURF™ SA-9 (Triton X-100 Ersatzartikel) |
|
| A9780 | TERGITOL™ 15-S-9 (Triton X-100 Ersatzartikel) |
68131-40-8 |
Das Original, Triton X-100 wurde aufgrund der REACH Verordnung als Substanz mit hohem Risiko eingestuft und kann nicht mehr so einfach verkauft werden.
Die Techniken der Proteinbiochemie werden nicht nur genutzt, um natürliche Zustände von Proteinen zu bestimmen, sondern mittels gezielter Manipulationen werden auch gewünschte Proteine hergestellt. Dazu bedient man sich sogenannter Expressionssysteme. Eines der bekanntesten ist das Lac-operon. Hier werden die Gene für bestimmte Proteine molekularbiologisch mit diesem Operon zusammengefügt. In Bakterien (E. coli) werden dann durch den Organismus die Proteine hergestellt. Das Ganze wird hierbei durch die Substanz Isopropyl-β-D-thiogalactopyranosid (IPTG) induziert. Vom IPTG halten wir eine Auswahl für unsere Kunden bereit.
| PRODUKTCODE | PRODUKTNAME | CAS NUMMER |
| A1008 | IPTG BioChemica | 367-93-1 |
| A4773 | IPTG für die Molekularbiologie, Dioxan frei | 367-93-1 |
| A7211 | IPTG aus pflanzlicher Galactose, Dioxan frei | 367-93-1 |
Der größte Gegner eines Proteins ist … ein anderes Protein. Der Abbau wird durch Proteasen katalysiert. Diese finden sich in allen Organismen und damit auch oft in den Proben der Anwender/Wissenschaftler wieder. Da es oft unwirtschaftlich wäre, direkt eine Trennung zu erzielen kommen sogenannte Inhibitoren zum Einsatz. Diese stören die katalytische Aktivität der Proteasen, sodass diese nicht aktiv werden können und andere Enzyme intakt bleiben.
Manchmal jedoch ist genau der Proteinabbau erwünscht. Zum Beispiel, wenn man in einer Probe nur die Nukleinsäuren untersuchen möchte. Die Proteine können dann störend sein. Ein bekanntes Beispiel dürften gewisse Testkits für COVID-19 sein. Proteinase K ist eine Protease, die den Abbau von Proteines katalysiert. Wir bieten hochqualitative Proteinase K in lyophilisierter und bereits gelöster ready-to-use Form an.
Weitere wichtige Produkte, die genutzt werden, sind Albumine und Co-Faktoren wie NAD und NADPH. Sie können als Stabilisator oder als Koenzyme in verschiedenen Reaktionen von Nöten sein.
Das Feld der Proteomik wird noch sehr lange spannend bleiben. Es zeigt uns den wirklichen Ist-Zustand einer jeden Zelle an. Viele Assays werden hier noch zu einigen bahnbrechenden Entdeckungen führen.
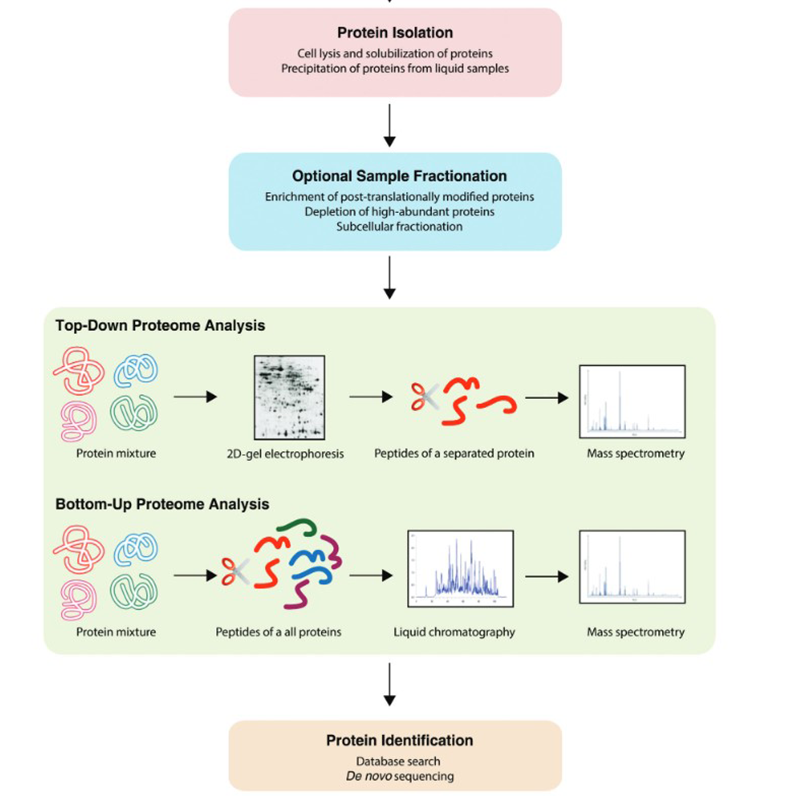
Neben bereits oben genannten Techniken findet man im Bereich der Proteomik eine Vielzahl an Workflows. Diese können Botton-Up oder Top-Down stattfinden:
.png)
Proteomik wird unter anderem auch durch Modelle betrieben, bei denen Zell oder auch tierbasierte Modelle Einsatz finden. 2D Gelelektrophorese und Labelling spielen eine Rolle. Große Schritte im Bereich der Proteomik wurde durch chromatographische Verfahren gekoppelt mit Massenspektrometrie gemacht. Hierzu finden sie bei uns die gängigen Lösungsmittel.
Heutzutage gängige Methoden der Proteomik sind unter anderen die Chromatographie, Massenspektrometrie, MALDI-Imaging, eindimensionale Polyacrylamidelektrophorse (1D PAGE), zweidimensionale Polyacrylamidgelelektrophorese (2D PAGE), Microarrays, Aminosäurenanalyse (AAA), Zellkultur und vor allem ein breiter Einsatz an bioinformatischen Modellen.
Ganz besonders in der Tumordiagnostik wird qualitative und quantitative Proteomik betrieben und erlaubt Rückschüsse für Prognosen und Therapien für den einzelnen Patienten.
Proteine sind auch in der Immunologie von großer Bedeutung. Auch unsere Antikörper sind besondere Formen von Proteinen.
Die Komplexität der Proteomik ergibt sich aus den sehr vielen Möglichkeiten: Laut Friedrich Lottspeich (österreichischer Biochemiker) hat der Mensch schätzungsweise mehrere hunderttausend bis Millionen verschiedene Proteine. Ein einzelnes Gen produziert im Schnitt fünf bis zehn Proteine, in manchen Fällen mehrere hundert. Diese Komplexität vollständig zu erfassen ist eine Herausforderung, der die derzeitigen Methoden noch nicht gewachsen sind. Auf der anderen Seite entwickelt sich die Proteomforschung rasant weiter. Das ist insbesondere auf eine ständige Verbesserung der Massenspektrometer zurückzuführen, die immer präziser, sensitiver und schneller werden.
Eine Übersicht wichtiger Artikel, passend für die Erforschung der Proteinbiochemie (Proteomik) finden sie unterhalb:
| PRODUKTCODE | PRODUKTNAME | CAS NUMMER |
| A1088 | ABTS BioChemica | 30931-67-0 |
| A4983 | Acrylamid - Lösung (30%) - Mix 29 : 1 für die Molekularbiologie | |
| A3626 | Acrylamid - Lösung (30%) - Mix 37,5 : 1 für die Molekularbiologie | |
| A3658 | Acrylamid - Lösung (40%) - Mix 19 : 1 für die Molekularbiologie | |
| A0385 | Acrylamid - Lösung (40%) - Mix 29 : 1 für die Molekularbiologie | |
| A4989 | Acrylamid - Lösung (40%) - Mix 37,5 : 1 für die Molekularbiologie | |
| A7582 | Acrylamid 2K - Lösung (18%) zur Denaturierung von DNA-PAGE | |
| A7590 | Acrylamid 2K - Lösung (8%) für die denaturierende DNA-PAGE | |
| A1089 | Acrylamid 2K Standardpräparat, extrapure | 79-06-1 |
| A0951 | Acrylamid 4K - Lösung (30%) - Mix 29 : 1 | |
| A1672 | Acrylamid 4K - Lösung (30%) - Mix 37,5:1 | |
| A1577 | Acrylamid 4K - Lösung (40%) - Mix 37,5:1 | |
| A1090 | Acrylamid 4K ultrapure | 79-06-1 |
| A1421 | AEBSF - Hydrochlorid BioChemica | 30827-99-7 |
| A0850 | Albumin für EIA und RIA | 9048-46-8 |
| A2244 | Albumin - Fraktion V (pH 5,2) | 9048-46-8 |
| A1391 | Albumin - Fraktion V (pH 7,0) | 9048-46-8 |
| A6588 | Albumin Fraktion V (pH 7,0) für Western blotting | 9048-46-8 |
| A4344 | Albumin roh aus Hühnereiweiss | 9006-59-1 |
| A1523 | 4-Aminoantipyrin BioChemica | 83-07-8 |
| A7708 | AppliCoat Plate Stabilizer | |
| A2132 | Aprotinin BioChemica | 9087-70-1 |
| A2568 | Avidin BioChemica | 1405-69-2 |
| A1117 | BCIP BioChemica | 6578-06-9 |
| A3636 | Bisacrylamid für die Molekularbiologie | 110-26-9 |
| A3417 | CheLuminat-HRP PicoDetect | |
| A2144 | Chymostatin | 9076-44-2 |
| A1101 | DTT BioChemica | 3483-12-3 |
| A2948 | DTT für die Molekularbiologie | 3483-12-3 |
| A3668 | DTT - Lösung (1 M) für die Molekularbiologie | 3483-12-3 |
| A1007 | X-Gal BioChemica | 7240-90-6 |
| A4978 | X-Gal für die Molekularbiologie | 7240-90-6 |
| A2243 | L-Glutathion oxidiert BioChemica | 27025-41-8 |
| A9782 | L-Glutathion reduziert (USP) reinst, Pharmaqualität | 70-18-8 |
| A2084 | L-Glutathion reduziert BioChemica | 70-18-8 |
| A1008 | IPTG BioChemica | 367-93-1 |
| A4773 | IPTG für die Molekularbiologie, Dioxan frei | 367-93-1 |
| A7211 | IPTG aus pflanzlicher Galactose, Dioxan frei | 367-93-1 |
| A2185 | Luminol | 521-31-3 |
| A0830 | Magermilchpulver | |
| A1108 | β-Mercaptoethanol für die Molekularbiologie | 60-24-2 |
| A1243 | NBT BioChemica | 298-83-9 |
| A1272 | 2-Nitrophenyl-β-D-galactopyranosid BioChemica | 369-07-3 |
| A1028 | 4-Nitrophenyl-β-D-glucuronid BioChemica | 10344-94-2 |
| A2205 | Pepstatin A | 26305-03-3 |
| A0999 | PMSF BioChemica | 329-98-6 |
| A2935 | Ponceau S - Lösung | |
| A8889 | Protein Marker VI (10 – 245) prestained | |
| A1495 | Streptavidin ultrapure | 9013-20-1 |
| A1148 | TEMED | 110-18-9 |
| A3840 | 3,3',5,5'-Tetramethylbenzidin BioChemica | 54827-17-7 |
| A1828 | Trypsin-Inhibitor aus Sojabohnen > 7000 BAEE | 9035-81-8 |