Packungsgrößen (4)
| Code | Packungsgröße | Einzelpreis | Boxpreis pro Stück | |
|---|---|---|---|---|
| Produktnr. & Packungsgröße | Einzelpreis | |||

|
Code
258462.0955
|
Packungsgröße
50x20 ml
|
Einzelpreis
Stück
157,60€
|
Boxpreis pro Stück
|

|
Code
258462.0961
|
Packungsgröße
50x40 ml
|
Einzelpreis
Stück
168,10€
|
Boxpreis pro Stück
|

|
Code
258462.0962
|
Packungsgröße
50x30 ml
|
Einzelpreis
Stück
162,90€
|
Boxpreis pro Stück
|

|
Code
258462.1255
|
Packungsgröße
11x20 ml
|
Einzelpreis
Stück
34,60€
|
Boxpreis pro Stück
|
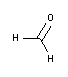
Technische Daten
- Dichte:
- 1,019 kg/l
- Löslichkeit:
- mit Wasser mischbar
- Physikalische Daten:
- flüssig
- Produktnummer:
- 258462
- Produktname:
- Histofix®-Safe Konservierungsmittel gebrauchsfertig (CE-IVD) für die klinische Diagnostik
- Qualität:
- für die klinische Diagnostik
- Spezifikation:
- Gehalt (iodometr.): 3,7-4,0 %
pH: 6,8-7,2
Methanol (w/v): 1 - 1,5 %
- Gefahrenpiktogramme
-
- Lagerung:
- RT
- Signalwort:
- Gefahr
- GHS Symbole:
- GHS08
GHS07
- H-Sätze:
- H350
H317
H341
H302
- P-Sätze:
- P201
P202
P261
P272
P280
P281
P302+P352
P308+P313
P321
P333+P313
P363
P405
P501
- Mastername:
- Histofix®-Safe Konservierungsmittel gebrauchsfertig
- HS:
- 38229000
Dokumente
Anfrage
Comments
HistologieDie Histologie ist der Bereich der Biologie, der sich mit der Zusammensetzung, Struktur und den Eigenschaften der organischen Gewebe von Lebewesen beschäftigt. Die Histologie ist eng mit der mikroskopischen Anatomie verwandt, da ihr Studium nicht bei den Geweben aufhört, sondern darüber hinausgeht, indem sie auch Zellen im Inneren und andere Korpuskeln beobachtet; zudem ist sie mit der Biochemie, Zytologie und Medizin verwandt.
Die Histologie hat in der Medizin und Biologie eine große Bedeutung erlangt, da sie für diese Disziplinen entscheidend ist, da sie in den Schnittpunkten Biochemie, Molekularbiologie und Physiologie einerseits und pathologischen Prozessen und deren Folgen andererseits liegt.
Die klassischen Techniken der Histologie werden in medizinischen Labors zur Diagnose einer Vielzahl von Krankheiten eingesetzt. Diese Techniken sind in den meisten diagnostischen Fällen ausreichend. Wenn jedoch die Diagnose mit diesen klassischen Techniken nicht als zuverlässig angesehen werden kann, müssen zusätzliche Methoden eingesetzt werden. Zu diesen Techniken gehören histochemische Färbungen, immunhistochemische Methoden, DNA-Hybridisierung, Fluoreszenz-in-situ-Hybridisierung (FISH), PCR, Durchflusszytometrie und andere.
Die oben genannten medizinischen Laboratorien konzentrieren sich in erster Linie auf die produktionsbasierte angewandte Wissenschaft (Anzahl der diagnostischen Tests), im Gegensatz zu Forschungslaboratorien, die sich auf akademischer Basis auf die Grundlagenwissenschaft konzentrieren.
Ein medizinisches Labor oder klinisches Labor ist hierbei der Ort, an dem normalerweise Tests an klinischen Proben durchgeführt werden, um Informationen über die Gesundheit eines Patienten im Hinblick auf Diagnose, Behandlung und Prävention von Krankheiten zu erhalten.
Forschungslabore verwenden konventionelle Techniken für Genomics, Proteomics und Zellkulturverfahren.
PanReac AppliChem-Markenprodukte für Krankenhauslabore:
• Medizinische Laboratorien: Mikroskopie-Produkte.
• Forschungslaboratorien: Produkte für Genomik, Proteomik und Zellkultur.
Medizinische Labore
In vielen Ländern gibt es hauptsächlich zwei Arten von medizinischen Laboratorien, abhängig von der Art der durchgeführten Forschung.
• Krankenhauslabore: Labore, die in ein Krankenhaus integriert sind, um Tests an Patientenproben durchzuführen. Es gibt 4 verschiedene Arten von Laboratorien
• Laboratorien für klinische Pathologie: Hämatologie, Histopathologie, Zytologie, Routinepathologie.
• Klinische Mikrobiologie-Laboratorien: Bakteriologie, Mykobakteriologie, Virologie, Mykologie, Parasitologie, Immunologie, Serologie.
• Klinisch-biochemische Laboratorien: biochemische Analysen, Hormontests, etc.
• Molekulardiagnostisches Labor oder zytogenetisches und molekularbiologisches Labor.
• Externe klinische Labore: für extrem spezialisierte Tests kann die Probe in ein externes Forschungslabor gehen.
ITW Reagents bietet unter der Marke PanReac AppliChem ein komplettes Sortiment an Produkten für die Histologie, Hämatologie und Mikrobiologie, einschließlich der am häufigsten verwendeten Reagenzien im Prozess der Probenvorbereitung für mikroskopische Untersuchungen. Dieses Sortiment deckt alle Stufen der Fixierung, Klärung, Paraffineinbettung, Färbung und Montage ab. ITW-Reagenzien bieten auch eine breite Palette von Produkten für die Forschung in verschiedenen Bereichen der Biowissenschaften für Assays, die in Krankenhauslabors entwickelt werden: Genomik, Proteomik und Zellkultur.
Viele der in der Mikroskopie verwendeten Produkte der Marke PanReac AppliChem tragen die CE-IVD-Kennzeichnung in Übereinstimmung mit der neuen europäischen Verordnung (EU) 2017/746 über In-vitro-Diagnostika (IVDR).
Histologische Verarbeitungstechniken und -stufen
Obwohl die meisten Schritte der histologischen Verarbeitung üblich sind, sind einige von ihnen einzigartig für eine bestimmte Art der Probenverarbeitung. Zum Beispiel wird die Einbettung nur bei Geweben und die Hitzefixierung nur bei Blutproben durchgeführt.
Die häufigsten Phasen und die verwendeten Produkte sind wie folgt:
• Fixierung: Die Fixierung unterbricht die Abbauprozesse, die nach dem Zelltod auftreten, und versucht, die Gewebe-/Zellarchitektur und -zusammensetzung so weit wie möglich zu erhalten, wie sie im lebenden Organismus war. Die gebräuchlichste Art ist die chemische Fixierung mit Formaldehyd 3,7-4,0 % w/v, gepuffert auf pH=7 und stabilisiert mit Methanol und, für erhöhte Sicherheit, mit dem gebrauchsfertigen Konservierungsmittel Histofix® Formaldehyd in Einzeldosen.
• Dehydratisierung und Klärung: Unter Dehydrierung versteht man den vollständigen Entzug von Wasser aus der Probe oder dem Gewebe, so dass sie ordnungsgemäß in die nachfolgenden nicht wasserlöslichen Einbettungsmedien eingebettet werden können. Die fixierten und gewaschenen Proben werden unterschiedlich lange in 96%igem Alkohol und anschließend in absolutem Alkohol eingelegt, in der Regel eineinhalb Stunden in jedem Bad. Bei der Klärung wird das Trocknungsmittel durch eine Substanz ersetzt, die mit dem zu verwendenden Einbettungsmedium mischbar ist. Die gebräuchlichsten Produkte in dieser Phase sind Alkohole wie absolutes Ethanol, 96%iges Ethanol, 70%iges Ethanol, die denaturiert oder nicht sein können, sowie Xylol.
• Einschluss: Durch den Einschluss wird das Wasser im Gewebe durch ein flüssiges Medium ersetzt, das sich unter geeigneten Temperaturbedingungen verfestigen kann. Hierfür wird Paraffinwachs P.F. 55-58°C plastifiziert + DMSO in Linsen oder einfach Paraffinwachs P.F. 56-58°C in Linsen verwendet.
• Schneiden: In Paraffin eingebettetes Gewebe wird so dünn geschnitten (4-6 Mikrometer), dass das Licht für die Untersuchung unter dem Mikroskop durchgelassen wird. Dies geschieht mit einem Mikrotom: ein mechanisches Instrument, mit dem mikrometrische Schnitte von Gewebe hergestellt werden. Wir empfehlen unseren Paraffinreiniger, um das Mikrotom sauber zu halten.
• Clearing-Hydrierung: Bei der Entwachsung-Hydrierung wird das Einbettungsmedium von in Paraffin eingebetteten Gewebeschnitten entfernt und sie werden rehydriert, damit der Farbstoff richtig eindringen kann. Die gebräuchlichsten Reagenzien in diesem Stadium sind Alkohole wie Absolutes Ethanol, Ethanol 96%, Ethanol 70%, die zusätzlich zu Xylol denaturiert sein können oder nicht.
• Färben: Die meisten Gewebe, insbesondere solche tierischen Ursprungs, sind farblos, es sei denn, sie enthalten Pigmente. Daher müssen sie für die mikroskopische Betrachtung gefärbt werden. Dies geschieht mit Hilfe von Farbstoffen, Substanzen, die sich bei Kontakt mit einem geeigneten Träger dauerhaft an diesen binden und seine Farbe übertragen. Die am häufigsten verwendeten Farbstoffe sind Hämatoxylin und Eosin, aber es gibt eine Vielzahl von Färbemitteln, je nach dem zu färbenden Gewebe.
• Einbetten und Eintauchen: Nachdem die Präparate gespült worden sind, müssen sie endgültig eingebettet werden. Einbettmittel können wässrig oder nicht-wässrig sein; welcher Typ verwendet wird, hängt vom jeweiligen Protokoll ab. Beispiele für Einbettmittel sind DPX, Canada Balsam und Eukitt®. Einbettmittel sind Flüssigkeiten, oft natürliche Öle, die einen definierten Brechungsindex haben. Es ist wichtig, dass der Brechungsindex etwa 1,5 beträgt (gleicher Index wie Glas). Dies ermöglicht ein homogenes Eintauchen des Öls. Zu diesem Zweck wird Immersionsöl oder Zedernöl verwendet.
• Mikroskopische Analyse: Dies ist die Phase der mikroskopischen Beobachtung. Es werden keine zusätzlichen Reagenzien benötigt.
FAQs
Was ist Histologie?
Die Histologie ist ein Fach der Biologie/Medizin, das sich mit dem Aufbau, der Struktur und den Eigenschaften der organischen Gewebe von Lebewesen beschäftigt. Die Histologie steht in engem Zusammenhang mit der mikroskopischen Anatomie, da sie sich nicht auf die Gewebe beschränkt, sondern darüber hinaus auch die Zellen im Inneren und andere Teilchen untersucht und sich mit Biochemie und Zytologie befasst.Was versteht man unter Fixierung in der Histologie?
Im Bereich der Histologie, Pathologie und Zellbiologie besteht die Fixierung darin, biologische Gewebe vor dem Verfall durch Autolyse oder Fäulnis zu bewahren. Sie stoppt jede laufende biochemische Reaktion und kann auch die mechanische Festigkeit oder Stabilität des behandelten Gewebes erhöhen. Die Fixierung des Gewebes ist ein grundlegender Schritt bei der Vorbereitung histologischer Schnitte. Das übergeordnete Ziel der Fixierung besteht darin, Zellen und Gewebebestandteile so zu konservieren, dass dünne und gefärbte Schnitte hergestellt werden können. Dies ermöglicht die Untersuchung der Gewebestruktur, die durch die Form und Größe von Makromolekülen (in und um Zellen) wie Proteinen und Nukleinsäuren bestimmt wird.Was versteht man unter Autolyse?
Die Zerstörung von Zellen oder Geweben durch ihre eigenen Enzyme, insbesondere durch die von Lysosomen freigesetzten, wird als Autolyse bezeichnet.Was versteht man unter Fäulnis?
Fäulnis ist die Zersetzung organischer Stoffe, insbesondere die typischerweise anaerobe Spaltung von Proteinen durch Bakterien und Pilze unter Bildung übel riechender, unvollständig oxidierter Produkte. Der Prozess der Fäulnis wird durch die in der Umwelt vorhandenen Bakterien in Gang gesetzt. Diese Bakterien bauen die organischen Stoffe ab und produzieren Abfallprodukte wie Methan und Ammoniak. Diese Gase lassen das Objekt anschwellen und geben einen üblen Geruch ab.Was ist ein Gewebeinfiltrationsmedium?
Ein Gewebeinfiltrationsmedium ist eine spezielle Formulierung aus gereinigtem Paraffin und Kunststoffpolymeren zur Infiltration oder Einbettung der biologischen Probe.Wie kann ich Wasser aus einer Gewebeprobe/Biopsie entfernen?
Dieses Verfahren wird in der Regel durch Eintauchen der Proben in eine Reihe von Ethanol (Alkohol)-Lösungen mit steigender Konzentration durchgeführt, bis reiner, wasserfreier Alkohol erreicht ist. Ethanol ist in allen Verhältnissen mit Wasser mischbar, so dass das Wasser in der Probe nach und nach durch den Alkohol ersetzt wird.Welche Lösungsmittel kann ich für die Entfernung von Wasser in Gewebeproben/Biopsien in der Histologie/Pathologie verwenden?
Absoluter Ethanol, Ethanol 96 %, Ethanol 70 % sind die am häufigsten verwendeten Lösungsmittel. Da geschmolzenes Paraffin hydrophob (nicht mit Wasser mischbar) ist, muss der größte Teil des Wassers in einer Probe entfernt werden, bevor sie mit Paraffin infiltriert werden kann. Dieser Vorgang wird in der Regel durch Eintauchen der Proben in eine Reihe von Ethanol (Alkohol)-Lösungen mit steigender Konzentration durchgeführt, bis reiner Alkohol ohne Wasser erreicht wird. Ethanol ist in jedem Verhältnis mit Wasser mischbar, so dass das Wasser in der Probe nach und nach durch den Alkohol ersetzt wird. Um eine übermäßige Schädigung des Gewebes zu vermeiden, wird eine Reihe steigender Konzentrationen von Alkohol verwendet.Was versteht man unter einer abgestuften Dehydratisierungsserie bei der Biopsievorbereitung in der Histologie?
Unter Dehydratisierung versteht man den vollständigen Entzug von Wasser aus dem fixierten Gewebe. Für die Dehydratisierung werden abgestufte Konzentrationen von Ethanol verwendet; das Gewebe wird in 70%iges Ethanol in Wasser getaucht, gefolgt von 96%igen und 100%igen Lösungen. Ethanol gewährleistet eine vollständige Dehydratisierung und ist daher das bevorzugte Reagenz für die Verarbeitung von elektronenmikroskopischen Proben. Bei empfindlichem Gewebe wird empfohlen, die Verarbeitung in 30%igem Ethanol zu beginnen. Trocknungsmittel müssen wasserlöslich sein, und Ethanol ist das am häufigsten verwendete Trocknungsmittel. Ethanol hat mehrere besondere Eigenschaften für die Dehydratisierung: vollständige Mischbarkeit mit Wasser, härtende Wirkung, hohe Dehydratisierungskraft und Gewebedurchlässigkeit. Um eine übermäßige Versteifung des Gewebes zu vermeiden, ist es in der Regel erforderlich, Ethanol in abgestuften Konzentrationen (in der Regel 70%, 80%, 95% und absolutes Ethanol) zu verwenden, um das Wasser im Gewebe schrittweise zu ersetzen. Anstelle von EtOH kann auch Isopropanol verwendet werden, allerdings mit Änderungen am Standard-Dehydratisierungsprotokoll. Je nach Größe oder Art der Proben muss man die Zeit im abgestuften Isopropanol optimieren. Sehr kleine Proben können überhärten, und fettige oder größere Proben müssen länger dehydriert werden. Isopropanol vermischt sich nicht mit Paraffin, so dass ein Klärmittel wie Xylol verwendet werden muss.Was ist Hellfeldmikroskopie?
Die Hellfeldmikroskopie (BF) ist die einfachste der Beleuchtungsmethoden in der optischen Mikroskopie. Die Probe wird mit weißem Licht durchleuchtet (d. h. von unten beleuchtet und von oben betrachtet), und der Kontrast der Probe ergibt sich aus der Abschwächung des durchgelassenen Lichts in den dichten Bereichen der Probe. Die Hellfeldmikroskopie ist die einfachste der Techniken, die zur Beleuchtung von Proben in optischen Mikroskopen verwendet werden, und ihre Einfachheit macht sie zu einer sehr beliebten Technik. Das typische Aussehen eines Hellfeldmikroskopiebildes ist das einer dunklen Probe auf hellem Hintergrund, daher der Name.Was versteht man unter Dehydratisierung in der Histologie?
Unter Dehydratisierung versteht man den vollständigen Entzug von Wasser aus fixiertem Gewebe. Für die Dehydratisierung werden abgestufte Konzentrationen von Ethanol verwendet; das Gewebe wird in 70%iges Ethanol in Wasser getaucht, gefolgt von 96%igen und 100%igen Lösungen. Die meisten Infiltrationsmedien (die feste Trägermatrix zum Schneiden von Gewebeproben) sind hydrophob, so dass den Geweben vor der weiteren Verarbeitung das Wasser entzogen werden muss. Es gibt zwei allgemeine Methoden zur Dehydratisierung von Geweben. Die gebräuchlichste Methode ist der allmähliche Ersatz von Wasser durch ein organisches Lösungsmittel, indem das Gewebe durch Lösungen mit steigender Konzentration (Ethanol, Aceton) transportiert wird - dies wird als abgestufte Dehydratisierungsreihe bezeichnet. Eine weniger verbreitete Methode in der Hellfeldmikroskopie ist die schnelle Dehydratisierung mit einem organischen Reagenz (2-Methoxyethylacetat, Dimethoxypropan, Triethylphosphat). Durch die schnelle Dehydratisierung wird das Wasser im Gewebe schnell ersetzt, ohne dass die Oberflächenspannung beeinträchtigt wird, wie es bei Alkoholen oder Aceton der Fall sein kann. 2-Methoxyethylacetat und Dimethoxypropan haben hydrophile und hydrophobe Bereiche. Dadurch kann das Lösungsmittel mit biologischen Membranlipiden interagieren, ohne sie zu zerstören. Die resultierende Dehydratisierung erfolgt durch einen Massenflussmechanismus und nicht durch eine chemische Reaktion. Der relative Nutzen der einzelnen Methoden ist subjektiv und hängt von den betroffenen Geweben und den persönlichen Vorlieben ab. In der Vergangenheit war die schnelle Dehydratisierung auf Kunststoffinfiltrationsverfahren beschränkt, kann aber durchaus auch bei Paraffintechniken eingesetzt werden.Was versteht man unter Färbung in der Histologie?
Eine Färbung oder ein Farbstoff ist ein Hilfsmittel, das in der Mikroskopie verwendet wird, um den Kontrast des unter dem Mikroskop gesehenen Bildes zu erhöhen. Färbemittel sind Substanzen, die in der Biologie und Medizin häufig verwendet werden, um Strukturen in biologischen Geweben hervorzuheben, die mit verschiedenen Mikroskoptypen betrachtet werden sollen. Verschiedene Farbstoffe können verwendet werden, um die Schärfe zu erhöhen und große Gewebeschnitte zu untersuchen (z. B. Hervorhebung von Muskelfasern oder Bindegewebe), um Zellpopulationen hervorzuheben (z. B. Sortierung verschiedener Blutzellen) oder sogar um Organellen innerhalb einzelner Zellen hervorzuheben. In der Biochemie bedeutet dies, dass einem Substrat ein spezifischer Farbstoff (der selektiv entweder an DNA, Proteine, Lipide, Kohlenhydrate usw. bindet) hinzugefügt wird, um das Vorhandensein einer bestimmten Verbindung zu qualifizieren oder zu quantifizieren. Sowohl Färbung als auch Fluoreszenzmarkierung können demselben Zweck dienen. Verschiedene Arten von biologischen Farbstoffen werden auch zur Markierung von Zellen in der Durchflusszytometrie und zur Markierung von Proteinen oder Nukleinsäuren in der Gelelektrophorese verwendet.Welche Färbungen werden in der Histologie verwendet?
Die in der Histologie am häufigsten verwendeten Färbungen sind die folgenden: Routinefärbungen: Hämatoxylin & Eosin; Spezialfärbungen: Van Gieson, Toluidinblau, Alcianblau, Giemsa, Reticulin, Nissl, Orcein, Sudanschwarz B. Masson's Trichrome, Mallory's Trichrome, Azan Trichrome, Cason's Trichrome, Periodic Acid Schiff, Weigert's Resorcin und Fuchsin.Wie kann ich eine Biopsie fixieren?
Eine Biopsie kann mit Formaldehyd oder Formalin fixiert werden. Dieser Vorgang wird als Fixierung bezeichnet. Der Zweck von Formaldehyd oder Formalin besteht darin, das Gewebe zu fixieren, um die autolytischen Veränderungen in den Biopsien zu stoppen. Alle Proben sollten unmittelbar nach der Exzision in 10 %iges, neutral gepuffertes Formalin gelegt werden, damit sie "fixieren" können. Idealerweise sollte die Menge des Fixiermittels mindestens das Zehnfache des Volumens der Probe betragen.Was ist der Unterschied zwischen Formaldehyd und Formalin?
Der Unterschied besteht im Wesentlichen darin, dass Formaldehyd ein farbloses, wasserlösliches, bei Raumtemperatur entflammbares Gas ist, das einen scharfen, irritierenden Geruch hat. Formalin hingegen ist eine Flüssigkeit, die durch Mischen von Formaldehydgas und Wasser hergestellt wird. Dies ist der Hauptunterschied zwischen Formalin und Formaldehyd. Im Allgemeinen enthält eine gesättigte Formalinlösung etwa 40 % (Volumen) oder 37 % (Gewicht) Formaldehydgas und einen Stabilisator, der die Polymerisation von Formaldehyd verhindert.Ist Formaldehyd krebserregend?
Formaldehyd ist eine der am gründlichsten untersuchten Substanzen. Im Jahr 2014 wurde Formaldehyd als krebserregend der Kategorie 1B neu eingestuft. Die neue Einstufung trat im Juni 2014 mit der Veröffentlichung im Amtsblatt der Europäischen Union in Kraft (VERORDNUNG (EU) Nr. 605/2014 DER KOMMISSION vom 5. Juni 2014).Warum wird Ethanol in der Histologie verwendet?
In der Histologie wird Ethanol als Dehydratisierungs- und Rehydratisierungsmittel verwendet. Die Dehydratisierung dient dazu, die Probe für die Einbettung in Paraffin vorzubereiten und das Paraffin mit Hilfe von Xylol als Zwischenlösungsmittel zu entfernen. Xylol ist mit Wasser nicht mischbar. Ethanol 96% enthält etwas Wasser. Daher muss absolutes Ethanol als "Brücke" zwischen Xylol und 96%igem Ethanol verwendet werden.Warum wird Xylol in der Histologie verwendet?
In der Histologie wird Xylol für die Verarbeitung und Färbung von Geweben verwendet. Xylol wird für die Gewebeverarbeitung bevorzugt, weil es das Gewebe transparent macht, so dass das Paraffin das Gewebe vollständig umhüllen kann. Bei der Vorbereitung von Objektträgern für die Mikroskopie können mit Xylol Paraffinreste von den Objektträgern entfernt werden.Was ist die Paraffintechnik?
In der Histologie und Pathologie werden Biopsien mit Hilfe der Paraffintechnik fixiert und in Wachs eingebettet. Dadurch wird das Gewebe hart und lässt sich mit dem Mikrotom viel leichter schneiden. Die Schnitte werden dann gefärbt und mit einem Lichtmikroskop untersucht.Was bedeutet Histofix®?
Histofix® ist die Marke von ITW Reagents für alle Produkte, die mit der Fixierung histologischer Proben zu tun haben. Dazu gehören Formaldehyd für die reguläre Fixierung von Biopsien, Formaldehyd rosa für die Fixierung von Kleinstbiopsien und die Entkalker für die Fixierung von Knochen.Was kann ich mit Histofix®-Safe machen?
Histofix®-Safe wird zur Fixierung von histologischen und pathologischen Proben in einem Formalin-Null-Kontakt-Gerät zur Bearbeitung und Vorbereitung von Biopsien für die mikroskopische Analyse verwendet.Was ist Histofix®-Safe?
Histofix®-Safe ist ein geschlossener Behälter, der in der Pathologie und Histologie verwendet wird und es ermöglicht, biologische Proben oder Biopsien hochsicher zu fixieren, wobei der Kontakt mit krebserregendem Formaldehyd so weit wie möglich vermieden wird.Welche Flüssigkeit wird in Histofix®-Safe verwendet?
Histofix®-Safe enthält 4% verdünntes Formalin, gepuffert und stabilisiert mit Methanol, um biologische Proben oder Biopsien für die mikroskopische Analyse zu fixieren.Woraus ist Histofix®-Safe hergestellt?
Das Histofix®-Safe Gerät besteht zu 100 % aus recycelbaren Kunststoffen wie Polypropylen, was eine umweltfreundliche Probenentsorgung und die Wiederverwertung von Kunststoff ermöglicht.Wie funktioniert der Histofix®-Safe Verschluss?
Der Histofix®-Safe-Verschluss ist bidirektional, so dass Formalin von einem Behälter in den anderen fließen kann, solange Druck auf einen der beiden Behälter ausgeübt wird. Dies wird erreicht, indem der obere Behälter gedrückt wird, bis die gesamte Flüssigkeit durch das bidirektionale Ventil in den unteren Behälter fließt. Die Probe wird in das Formaldehyd getaucht und der Fixierungsprozess beginnt. Wenn kein Druck ausgeübt wird, fließt das Formalin nicht von einem Behälter in den anderen.Ist Histofix®-Safe patentiert?
Ja, das Histofix Safe Gerät ist seit Januar 2021 patentiert (Patentnummer WO2021/016060A9).Wo kann ich Histofix®-Safe kaufen?
Histofix®-Safe kann über unser weltweites Händlernetz bezogen werden.Was ist der Vorteil von Histofix®-Safe?
Der Hauptvorteil von Histofix®-Safe besteht darin, dass biologische Proben oder Biopsien fixiert und transportiert werden können, ohne dass die Gefahr besteht, Formalindampf einzuatmen oder damit in Kontakt zu kommen. Das Histofix®-Safe-Gerät ist außerdem leicht zu lagern und zu transportieren, besteht aus wiederverwertbarem Kunststoff, ist einfach zu bedienen und intuitiv.Welche Proben kann ich für Histofix®-Safe verwenden?
Jede Art von biologischer Probe oder Biopsie, die vom Volumen her geeignet ist, kann verwendet werden. Die Probe sollte nicht zu groß sein, denn sie muss hineinpassen und es muss genügend Formalin für eine angemessene Fixierung vorhanden sein. Außerdem sollte die Probe oder Biopsie nicht zu klein sein, damit sie nicht durch das Gitter auslaufen kann.Welches Volumen soll ich wählen?
Das Histofix®-Safe Gerät ist in drei Packungsgrößen erhältlich: 20 mL, 30 mL und 40 mL. Das zu wählende Volumen hängt von der Menge der biologischen Probe ab. Das Volumen des Fixiermittels sollte proportional zum Volumen der Probe sein. Bei kleinen Biopsien kann in der Regel ein Flüssigkeitsvolumen verwendet werden, das mindestens dem 10-fachen Volumen des Gewebes entspricht.Was versteht man unter Fixierungszeit?
Die angemessene Fixierungszeit hängt auch vom Gewebevolumen und von der Art der Probe ab. Im Allgemeinen kann sie zwischen 6 Stunden für Nadel- oder endoskopische Biopsien und 24 Stunden für chirurgische Proben betragen.Trägt das Histofix®-Safe das CE IVD-Zeichen?
Ja, das Histofix®-Safe Gerät trägt das CE IVD-Zeichen in Übereinstimmung mit der neuen Verordnung (EU) 2017/746 über In-vitro-Diagnostika (IVDR), die die alte Richtlinie 98/79/EG ersetzt.Literature
[1] SEAP-IAP, DOCUMENTO DE RECOMENDACIONES DE LA SOCIEDAD ESPAÑOLA DE ANATOMÍA PATOLÓGICA-IAP REFERENTE A LAS MEDIDAS DE SEGURIDAD ACONSEJADAS EN EL MANEJO DEL FORMALDEHÍD0 Y ALO USO DE FIJADORES ALTERNATIVOS, Ángel Concha López, Ramiro Álvarez Alegret, Fina Autonell Reixach, Rocío Cabrera Pérez, Miguel Ángel Carrasco García, Ignacio Claros González, Sagrario García Sánchez , Javier Gómez Román, Teresa Hermida Romero, Teresa Hernández Iglesias, Antonio Martínez Lorente, Antonio Martínez Pozo, Beatriz Torio Sánchez, Enrique de Álava Casado.[2] Patentunterlagen: WO2021/016060A9 28. Januar 2021, EP3766579 - Behälter für biologische Proben, EP 3 766 579 A1 EUROPÄISCHE PATENTANMELDUNG, WO2021016060 - Behälter für biologische Proben








