In der Zellkultur ist es wichtig, sauber zu arbeiten, da Verunreinigungen für den Wissenschaftler sehr frustrierend und am Ende auch sehr teuer sind. ITW Reagents bietet eine Vielzahl von Produkten zur Prävention, Erkennung und Bekämpfung von Verunreinigungen an.
Mykoplasmen in der Zellkultur
Die Kontamination von Zelllinien mit Mykoplasmen ist ein weit verbreitetes und oft unterschätztes Problem. Obwohl sichtbare Anzeichen wie Trübung oder pH-Veränderungen selten sind, können Mykoplasmeninfektionen eine Reihe von zellulären Veränderungen verursachen, die von einer verlangsamten Wachstumsrate und veränderten immunologischen Eigenschaften bis hin zu metabolischen und morphologischen Veränderungen reichen. Die Folgen von Mykoplasmenverunreinigungen sind gravierend, sowohl in Bezug auf wissenschaftliche Methoden wie jede Art von zellbasiertem Assay als auch in Bezug auf Gesundheitsrisiken für Mensch und Tier.
Auf dieser Seite erfahren Sie mehr über den Nachweis von Mykoplasmenarten, die Behandlung kontaminierter Zellkulturen und die effektive Prävention von Neuinfektionen. Wir bieten auch einen breiten Hintergrund für ein besseres Verständnis der Ursachen und Folgen von Mykoplasmenverunreinigungen.
Nachweis von Mykoplasmenarten

Wie kann ich eine Mykoplasmenkontamination identifizieren?
Die empfindlichste Methode zum Nachweis von Mykoplasmen ist die Direktkulturmethode in geeigneten Brüh- und Agarmedien zur Gewinnung sichtbarer Kolonien. Theoretisch ist eine einzige CFU (Colony Forming Unit) pro Probenvolumen nachweisbar. Leider ist diese Methode auch die zeitaufwändigste (bis zu 28 Tage; wegen des langsamen Wachstums von Mykoplasmenarten) und erfordert erfahrenes Personal, das die Experimente unter kontrollierten Umweltbedingungen durchführt. Selbst wenn das schwierige Verfahren (beginnend mit der komplexen Medienzusammensetzung, die oft atypische Anpassungen für einzelne Spezies bis hin zur Analyse der Ergebnisse erfordert) richtig durchgeführt wird, ist die Methode nicht 100% effektiv, da einige anspruchsvolle Stämme in Reinkultur möglicherweise nicht wachsen. Daher sollte zusätzlich ein indirektes Nachweisverfahren durchgeführt werden.
Die empfindlichsten indirekten Mykoplasmentests basieren auf einer DNA-Fluorochrom-Färbung (z.B. mit DAPI, A1001) und PCR. Auch wenn die Nachweisgrenze dieser Verfahren niedriger ist als bei der Direktkulturmethode, sind sie für Routinetests absolut ausreichend. Häufig zeigen mykoplasmenverseuchte Zellkulturen eine hohe Dichte an Mykoplasmen (bis zu 107 - 108 CFU/ml), die für die Nachweisgrenzen dieser Verfahren gut geeignet sind. Im Gegensatz zur PCR-Alternative erfordert die traditionelle Fluoreszenzfärbemethode mehr Zeit und Erfahrung. Darüber hinaus ist der DNA-bindende fluoreszierende Farbstoff krebserregend und muss vorsichtig behandelt werden. Für routinemäßige Mykoplasmen-Screenings wird daher die PCR-Analyse empfohlen. Diese Methode ist empfindlich (je nach Kit fast so empfindlich wie die Direktkulturmethode), sehr schnell (Ergebnisse werden innerhalb von Stunden erzielt) und erkennt sowohl kultivierbare als auch nicht kultivierbare Mycoplasmenarten. Darüber hinaus ist diese Methode zumindest bei handelsüblichen Kits sehr einfach durchzuführen und erfordert kein spezifisches Fachwissen.
Die PCR Mykoplasmen-Testkits PanReac AppliChem ermöglichen die Identifizierung von mykoplasmenkontaminierten Zellkulturen - schnell und effektiv! Die PCR-Technik ermöglicht den hochsensitiven Nachweis sowohl kultivierbarer als auch nicht-kultivierbarer Mykoplasmenarten. Innerhalb weniger Stunden werden reproduzierbare Ergebnisse erzielt, so dass die PCR die Methode der Wahl für häufige Routinetests ist.
| Prod. Nr. | Beschreibung | Eigenschaften |
| A3744 | PCR Mykoplasmen-Testkit | Gebrauchsfertig (Taq-Polymerase inklusive!); enthält eine positive Kontroll-DNA. |
| A8994 | PCR Mykoplasmen-Testkit II | Höchste Empfindlichkeit von < 10 CFU/ml; nach Ph. Eur. (Abschnitt 2.6.7). Neben einer positiven Kontroll-DNA (nicht infektiös!) bietet dieses Kit eine interne Kontroll-DNA zur Visualisierung möglicher PCR-Hemmungen. Die DNA-Polymerase ist nicht enthalten, wir empfehlen eine Hotstart Taq-Polymerase, z.B. SuperHot Taq DNA Polymerase (A5231) |
PCR Mykoplasmen-Testkits: Wie funktionieren sie?!
Das Prinzip ist einfach: Ein mykoplasmaspezifisches DNA-Fragment wird ausschließlich durch PCR unter Verwendung eines spezifischen Primersets amplifiziert. Nur wenn Mykoplasmen-DNA in der Probe vorhanden ist, erhält man ein mykoplasmaspezifisches PCR-Produkt definierter Größe (270 bp) - nachweisbar auf einem Agarosegel oder, im Falle des qPCR-Testkits, über den FAM-Nachweiskanal. Der Primersatz bindet selektiv an die hochkonservierte 16S rRNA Operonenkodierungsregion des Mykoplasmengenoms und weist keine andere bakterielle oder eukaryontische DNA nach. Der Detektionsbereich umfasst die am häufigsten vorkommenden Schadstoffe M. fermentans, M. arginini, M. orale, M. hyorhinis, M. salivarium, M. hominis, aber auch weniger verbreitete Mykoplasmenarten, wie M. pneumoniae, Acholeplasma laidlawii, M. synoviae, M. pulmonis, M. bovis - um nur einige zu nennen.
Eine neue Generation von PCR Mycoplasma Testkits
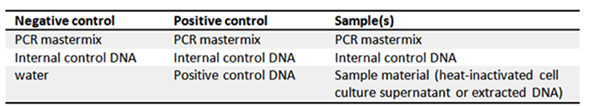
Neben einer Positivkontroll-DNA bietet das PCR Mykoplasmen Testkit II A8994 der neuen Generation eine optionale Internal Control DNA als Inhibitionsmarker. Zu diesem Zweck sollte die Internal Control DNA dem Master Mix hinzugefügt werden, um unvollständige oder gehemmte PCR-Läufe zu visualisieren. Darüber hinaus enthalten die Kits einen lyophilisierten Primer/Nucleotid Mix, eine Pufferlösung und Wasser in PCR-Qualität. Für eine optimale Auswertung der Ergebnisse wird dringend empfohlen, immer eine Negativ- und eine Positivkontrolle durchzuführen!
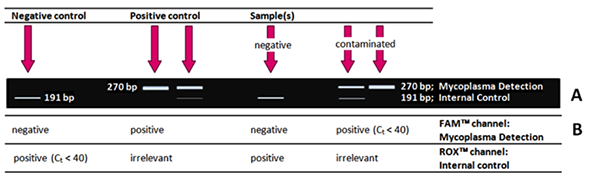
Was bekomme ich?! Wie werden meine Ergebnisse aussehen?
Wenn Ihre PCR erfolgreich war, erhalten Sie typischerweise folgende Ergebnisse für Negativkontrolle, Positivkontrolle, Negativ- und Positivprobe (kontaminiert) nach der Standard-PCR (Testkit II, A8994) und Auswertung mittels Agarosegelelektrophorese.
Hauptfaktoren
- Vermeiden Sie wiederholtes Einfrieren und Auftauen. Nach der Rekonstitution sind das Primer/Nukleotidgemisch, die Positivkontroll-DNA und die Interne Kontroll-DNA bei -20°C in geeigneten Aliquoten zu lagern. Es ist auch möglich, Aliquote des Mastermixes gebrauchsfertig in PCR-Gefässen bei -20°C zu lagern.
- Achten Sie darauf, dass die DNA der Internen Kontrolle während der Rekonstitution, des Aliquotierungsverfahrens oder des Pipettierens im Allgemeinen nicht verunreinigt wird. Um eine höchstmögliche Sensitivität des Mykoplasmennachweises zu gewährleisten, haben wir die niedrigste Konzentration der konkurrierenden Internal Control DNA präzise eingestellt - was sie sehr anfällig für mikrobiellen Abbau macht.
- Verwenden Sie eine geeignete DNA-Polymerase. Das Reaktionsgemisch ist optimiert für Hotstart Taq DNA Polymerasen; wir empfehlen SuperHot Taq DNA Polymerase (A5231)
- Verwenden Sie sterile, DNA-freie Schläuche. Vorsicht: Autoklavieren Sie Ihre PCR-Gefäße nicht, wenn der Autoklav auch zur Sterilisation von (mikrobiellen) Abfällen verwendet wird. Autoklaven sind eine Quelle von Nukleinsäureverunreinigungen in Labors und schlecht geeignet, um Nukleinsäuren zu zerstören. Beim Autoklavieren werden fragmentierte DNA-Moleküle in großen Mengen mit dem Dampf freigesetzt und kontaminieren leicht Materialien und Oberflächen, die mit ihnen in Berührung kamen.
- Die Proben sollten aus dem Überstand von Kulturen stammen, die sich zu 90-100 % im Zusammenfluss befinden. Bei durchschnittlichen Titern bei 106 und einem maximalen Titer bei 108 sind ausreichende Mengen an Mykoplasmen-DNA vorhanden, um eine sensitive PCR zu gewährleisten.
- Aktivieren Sie das Probenmaterial durch Hitzeeinwirkung. Probenmaterial aus Zellkulturen enthält DNasen, die Mykoplasmen-DNA auch bei niedrigen Temperaturen abbauen können. Daher empfehlen wir die Wärmeinaktivierung (direkte Erwärmung des Zellkulturüberstandes oder des biologischen Probenmaterials) unmittelbar nach der Probenahme - oder DNA-Extraktion.
- Achten Sie darauf, dass Ihre Probe keine PCR-Hemmer wie Zellablagerungen, Alkohol oder PBS-Puffer enthält. PCR-inhibierende Substanzen können sich auch im Medium älterer Kulturen ansammeln (>100% Konfluenz).
- Für kritische Probenmaterialien, wie alte Zellkulturen, Zellpellets sowie Fetalkalbserum und Impfstoffe, wird eine DNA-Extraktion vor dem Test unbedingt empfohlen. Achten Sie darauf, alkoholhaltige Waschpuffer aus der Zubereitung zu entfernen, um eine Koelution von Alkohol und Probenmaterial zu vermeiden.
Problemlösung

Kein internes Kontrollsignal in der Positivkontrolle (oder einer stark verunreinigten Probe).
Tatsächlich ist dies kein Problem, aber sehr wahrscheinlich, da beide PCR-Reaktionen konkurrieren! Die Internal Control DNA wird zum Nachweis der PCR-Inhibition in einer mykoplasmen-negativen Probe eingesetzt. Ist im Reaktionsgemisch keine Mykoplasmen-DNA-Vorlage vorhanden, wird ausschließlich die Internal Control DNA amplifiziert. In Gegenwart von Mykoplasmen-DNA wird die Internal Control DNA stark verdünnt, was zu einem sehr schwachen oder gar fehlenden Signal führt.

Kein internes Kontrollsignal bei der Negativkontrolle (und bei scheinbar negativen Proben).
Es gibt zwei mögliche Gründe für dieses Ergebnis: Entweder wurde die Internal Control DNA nicht dem Mastermix zugesetzt oder sie ist mit Bakterien verunreinigt, z.B. durch eine unsterile Pipettenspitze. Da sich die Internal Control DNA durch eine sehr niedrige Konzentration auszeichnet - um die höchstmögliche Sensitivität des Mykoplasmennachweises zu gewährleisten - wird sie von Bakterien schnell abgebaut.

Kein Signal in den Proben, weder für Mykoplasmen-DNA noch für interne Kontroll-DNA.
PCR-Hemmung. Gründe dafür können durch die Zelle freigesetzte Metaboliten sein, die die DNA-Polymerase hemmen oder andere störende Substanzen wie Alkohol oder phosphathaltige Puffer. Eine weitere Möglichkeit ist, dass das Probenmaterial (Zellkulturüberstand!) durch Zellreste kontaminiert sein kann. In all diesen Fällen ist eine DNA-Extraktion vor der PCR erforderlich.
Behandlung von kontaminierten Zellkulturen
Wie kann man Mykoplasmen aus einer infizierten Zellkultur entfernen?
Der einfachste Weg, Mykoplasmen zu beseitigen, besteht darin, die kontaminierten Zellen zusammen mit einer beliebigen Flasche Medium und Lösung, die in dieser entsprechenden Kultur verwendet wird, zu autoklavieren. Vergessen Sie nicht die anschließende Reinigung und Desinfektion von Oberflächen, Hauben, Inkubatoren, Pipetten etc. - oder besser gesagt, das ganze Labor! Achten Sie darauf, dass auch andere Zelllinien nicht infiziert werden!
Da sowohl der Aufwand als auch die Kosten hoch sind, ist die Reinigung einer kontaminierten Kultur durch Antimykoplasmenbehandlung nur bei sehr wertvollen oder unersetzlichen Kulturen sinnvoll - und wenn die potentielle Quelle des Mykoplasmas aus dem Labor verbannt wird.
Die zuverlässigste und effizienteste Behandlung von Mykoplasmenverunreinigungen ist trotz gesicherter Resistenzen die Zugabe geeigneter Antibiotika wie Chinolone, Tetracycline und Makrolide.
Neben den traditionellen Mykoplasmen-Eliminierungsmitteln Myco-1 & 2 (Tiamulin und Minozyklin) und Myco-3 (Ciprofloxacin) bietet ITW Reagents eine Lösung für die effektive und dauerhafte Entfernung von Mykoplasmenarten aus der Zellkultur: Myco-4 bietet ein breites Wirkungsspektrum (einschließlich aller Arten von Mykoplasmen, Acholeplasmen, Spiroplasmen und Entomoplasmen), kombiniert mit einer sehr geringen Zytotoxizität und einem geringen Widerstandsrisiko durch eine anfängliche biophysikalische Wirkungsweise.
| Prod. Nr. | Beschreibung | Eigenschaften |
| A5240 | Myco-3 | Einphasenbehandlung mit Ciprofloxacin. |
| A8366 | Myco-4 |
2-stufige Behandlung mit einem mykoplasmaspezifischen biophysikalischen Reagenz, gefolgt von einer geeigneten Antibiotika-Kombination. |

Mykoplasmenbeseitigung durch Myco-4: Wie funktioniert es?!
Myco-4 wird zur Beseitigung von Mykoplasmen, Acholeplasmen, Spiroplasmen und Entomoplasmen in allen Arten von Zellkulturen eingesetzt.Myco-4 ist eine hocheffiziente Kombination aus Standard-Antibiotika und einem biologischen Wirkstoff. Der biologische Wirkstoff integriert sich in die Mykoplasmenmamembran und beeinträchtigt deren Integrität. Durch die Kombination mit Standardantibiotika kann die effektive Dosis sowohl des biologischen Wirkstoffs als auch der Antibiotika auf ein Minimum reduziert werden, um die niedrigste Zytotoxizität zu erreichen, was dennoch zu einer sehr zuverlässigen und sicheren Beseitigung von Mykoplasmen führt. Darüber hinaus machen die biophysikalischen Eigenschaften von Myco-4 die Entwicklung resistenter Stämme sehr unwahrscheinlich.
Eine Anwendung umfasst 4 Probengefäße, ein Starter Treatment (rote Kappe) und drei Main Treatments (gelbe Kappe). Das Starter Treatment tötet die meisten Mykoplasmapartikel ab, ohne die Zellen zu schädigen. Die Main Treatments töten die restlichen Partikel ab, was zu einer dauerhaften Beseitigung mit Wirkungsgraden von bis zu 100% führt. Jede Komponente ist eine sterile, gebrauchsfertige Lösung.
Verunreinigte Zellen werden einmal mit der Starter Treatment Solution (für den üblichen Zeitraum einer normalen Passage oder mindestens 30 Minuten) und dreimal mit dem Myco-4 Main Treatment Reagenz (jeweils für den Zeitraum einer Passage) inkubiert.
Voraussetzung für eine erfolgreiche Mykoplasmeneliminierung ist eine begrenzte Anzahl von Einzelzellen und eine reduzierte Serumkonzentration während der Inkubation mit der Starter Treatment Solution!
Hauptfaktoren
- Verwenden Sie maximal 105 Zellen für eine Behandlung, um die Mykoplasmenbelastung gering zu halten und Interaktionen mit der Zelloberfläche zu vermeiden.
- Stellen Sie sicher, dass die Myco-4 Starter Behandlung bereits im Nährboden vorhanden ist, bevor Sie Zellen hinzufügen. Fügen Sie Zellen direkt in die Eliminierungsmischung ein, um Verdunstung zu vermeiden (stecken Sie die Pipettenspitze direkt in die Mischung!).
- Da die Myco-4 Starter Behandlung biophysikalisch durch die Assoziation mit der Mykoplasmenmembran funktioniert, benötigt das Reagenz einen direkten Kontakt mit dem Mykoplasmenpartikel, um wirksam zu sein. Behandeln Sie keine Zellhaufen. Wir empfehlen die Verwendung von Trypsin (A3964), um die Zellen voneinander zu trennen und die Zelloberflächen zu glätten
- Stellen Sie die Behandlung einzelner Zellen sicher (unter dem Mikroskop überprüfen). Gegebenenfalls die Dauer der Trypsin-Behandlung erhöhen oder die Zellen durch Auf- und Abpipettieren voneinander trennen.
- Die Eliminierung von Mykoplasmen in hochkonzentrierten Lösungen von Proteinen oder Lipiden ist nicht möglich. Die mykoplasmazide Aktivität des Myco-4 Starter Treatments wird durch Lipide und Proteine im Reaktionsgemisch beeinflusst, z.B. durch Komponenten in supplementiertem fetalen Kälberserum. Diese Inhaltsstoffe binden das Myco-4 Starter Treatment wirkungsvoll und verhindern dessen Bindung an die Mykoplasmenmembran. Unser Protokoll ist für maximal 5 % v/v fetales Kälberserum anwendbar. Für die Myco-4 Hauptbehandlung ist keine Reduktion des Serums auf 5 % mehr erforderlich; die FCS-Konzentration kann auf den üblichen Gehalt eingestellt werden.
- Myco-4 ist sowohl für adhärente als auch für Suspensionszelllinien geeignet. Zu den bereits erfolgreich behandelten Zelllinien gehören Vero, BHK21, GBK, ML, Hep2, 293, CRFK, Jurkat, Molt 4, MT-4. Viren werden in Kombination mit ihren Wirtszellen behandelt. Zellen, die Chlamydien oder andere Bakterien als Wirtssysteme beherbergen, können nicht behandelt werden. Der antibiotische Teil des Produkts kann die integrierten Mikroorganismen beeinträchtigen.
- Antibiotika, insbesondere wenn sie für die Selektion erforderlich sind, stören das Ausscheidungsverfahren nicht. In seltenen Fällen kann die Zytotoxizität durch unvorhersehbare Wechselwirkungen der Reagenzien erhöht werden.
- Myco-4 dringt nicht in die Zellmembran ein. Daher kann es eine intrazelluläre Kontamination nicht ausschließen. Mykoplasmen sind jedoch eine extrazelluläre Verunreinigung. Mycoplasma penetrans ist die einzige Spezies, die beschrieben wird, um intrazellulär zu persistieren. Bisher wurde M. penetrans nicht als Kontaminant in der Zellkultur gemeldet.
Mykoplasmen-Prävention

Wie kann ich Verunreinigungen vermeiden?!
Wahrscheinlich wird es nie einen Zeitpunkt geben, an dem Mykoplasmenverunreinigungen vollständig aus unseren Labors verbannt werden - solange dort Menschen arbeiten. Aber die Umsetzung einiger allgemeiner Grundsätze wird das Risiko von Verunreinigungen sicherlich minimieren und kostspielige oder peinliche Situationen vermeiden.
- Befolgen Sie streng aseptische Techniken und Praktiken, einschließlich unnötigem Reden, kein Mundpipettieren, keine Medienversorgung durch Ausgießen, regelmäßiges Händewaschen und Desinfizieren! Verwenden Sie den Laminarstrom nicht zur Lagerung von Lösungen und Geräten! Arbeiten Sie nur mit EINER Zelllinie auf einmal und verwenden Sie für jede Zelllinie eigene Materialien, um Kreuzkontaminationen zu vermeiden! Stellen Sie sicher, dass alle Medien, Lösungen und Materialien ordnungsgemäß sterilisiert sind - das Gleiche gilt natürlich auch für alle anderen anfallenden Abfälle!
- Reinigen und desinfizieren Sie häufig Oberflächen, Laminar Flow Werkbänke, Inkubatoren, Wasserbäder und alle anderen Geräte - vor und nach dem Arbeitsgang. Stellen Sie sicher, dass das Labor regelmäßig gereinigt wird und nur autorisierte Personen Zugang zum Arbeitsbereich haben.
- Verwenden Sie Antibiotika verantwortungsbewusst. Für Routinekulturarbeiten sollten antibiotikafreie Medien verwendet werden. Der allgemeine Einsatz von Antibiotika zur Maskierung von Hygienemängeln, das Fehlen guter aseptischer Techniken oder ungeeigneter Zellkulturanlagen ist kein Heilmittel! Im Gegenteil, der verantwortungslose Einsatz von Antibiotika wird die Situation noch verschlimmern. Vor allem die Kontaminationsraten mit Mykoplasmen sind in Zelllinien, die in antibiotikahaltigem Medium angebaut werden, viel höher als in antibiotikafreien Kulturen. Die meisten in der Zellkultur verwendeten Antibiotika wirken nicht auf Mykoplasmen! Neben allgemein unwirksamen Beta-Lactamen wurden sehr hohe Resistenzniveaus von Mykoplasmen gegen Streptomycin, Kanamycin, Gentamicin und Neomycin bestimmt.
- Jedenfalls gibt es nützliche Anwendungen für Antibiotika in der Zellkultur, z.B. innerhalb der ersten zwei Wochen der Primärkultur. Um keine neuen Resistenzen durch Inaktivierung des Antibiotikums zu erzeugen, sollte das antibiotikahaltige Medium regelmäßig aktualisiert werden. Als ausgezeichnete Alternative zu klassischen Zellkulturantibiotika wie PenStrep bietet ITW Reagents ein Produkt zur Verhinderung des mikrobiellen Wachstums in Zellkulturen: CellCultureGuard A8906. Diese Kombination ausgewählter Antibiotika (eines davon ist ein Fluorchinolon) bietet ein breites Spektrum an antimikrobieller Aktivität und macht es zu unserem Zellkulturreagenz erster Wahl: CellCultureGuard ist aktiv gegen extra- und intrazelluläre Bakterien, Mykoplasmen, Protozoen und Pilze (Hefen). Darüber hinaus ist es äußerst kompatibel mit Resistenzmarkern und birgt ein geringes Risiko der Resistenzentwicklung.
- Isolieren Sie ankommende Zellkulturen (verwenden Sie einen separaten Inkubator oder zumindest verschlossene Flaschen sowie separate Kulturmedien und -materialien), bis sich die Mykoplasmentestergebnisse als negativ erwiesen haben.
- Testen Sie regelmäßig auf Kontamination - unabhängig davon, ob die Zellkultur Antibiotika enthält oder nicht! Routinetests auf das Vorhandensein von Mykoplasmenarten sind für den verantwortlichen Wissenschaftler ein absolutes Muss! Nur durch die Identifizierung und Behandlung oder Eliminierung der infizierten Zelllinie wird das Risiko weiterer (Kreuz-) Verunreinigungen gebannt und Experimente liefern stabile und zuverlässige Ergebnisse.
ITW Reagents bietet eine Reihe von Produkten zur Verhinderung mikrobieller Kontaminationen - in Hauben, Inkubatoren, Wasserbädern und Zellkulturen.
| Prod. Nr. | Beschreibung | Eigenschaften |
| A5230 | Incubator-Clean™ | Ungiftiges und biologisch abbaubares Desinfektionsmittel für Inkubatoren und Sterilbänke; verhindert Kontamination und Wachstum von Pilzen, Bakterien (einschließlich Mykoplasmen) und Viren (einschließlich HIV und Hepatitis B). Vollständig kompatibel mit gängigen Arbeitsflächen (nicht korrosiv!) |
| A5219 | Incuwater-Clean™ | Ungiftiges, nichtflüchtiges und extrem wirksames Desinfektionsmittel für CO2-Inkubator-Wasserbäder. |
| A9390 | Aquabator-Clean (100X) | Desinfektionsmittel zur Verhinderung von mikrobiellem Wachstum in gängigen Wasserbädern. |
| A8906 | CellCultureGuard | Kombination von speziell ausgewählten Antibiotika zur Verhinderung des mikrobiellen Wachstums (extra- und intrazelluläre Bakterien, Mykoplasmen, Protozoen und Pilze) in Zellkulturen; bietet eine hohe Kompatibilität mit Resistenzmarkern und ein geringes Risiko der Resistenzentwicklung. |
Die Mykoplasmen-Geschichte: Was sollte man wissen?
Erstmalig 1956 veröffentlicht (Robinson et al. 1956), stellt das potenzielle Vorhandensein von Mykoplasmen in Zellkulturlabors die Wissenschaftler vor Herausforderungen. Die parasitären Mykoplasmen stellen für alle zelllinienbezogenen Bereiche in der Forschung sowie in Industrieanlagen zur Entwicklung oder Herstellung von zellbasierten biologischen und pharmazeutischen Produkten, einschließlich Impfstoffen, monoklonalen Antikörpern, Medikamenten und Produkten für die Gen- und Zelltherapie, ein ernstes Problem dar. Dennoch ist eine Reduktion der Infektionsraten von Zellkulturen nicht erkennbar (Ryan 2008), obwohl die Risiken und Folgen von Mykoplasmeninfektionen seit Jahrzehnten bekannt sind und Strategien zu deren Prävention, Erkennung und Beseitigung gut etabliert sind. Warum sind so viele Zelllinien - obwohl sie von ihren Zellkulturen meist gut gepflegt werden - immer noch unzureichend vor dem zellwandfreien Eindringling geschützt? Ist dies eine Ursache für Unachtsamkeit oder eher für mangelndes Wissen? Leider können wir zu dieser Frage keine Daten liefern - aber viele Fakten, die die Bedeutung des unbeliebten Themas belegen.
Wie gelangen Mykoplasmen üblicherweise in unsere Labore und Kulturen?
Mykoplasmen sind allgegenwärtig; ihr breites Spektrum an Wirten umfasst Menschen und andere Säugetiere, Vögel, Reptilien, Fische, Insekten und Pflanzen (Razin et al. 1998). In Zellkulturlabors werden jedoch 95% aller kontinuierlichen Zelllinieninfektionen durch nur sechs Arten verursacht, die ursprünglich von Rindern (M. arginini & Acholeplasma laidlawii), Schweinen (M. hyorhinis) - und Menschen (M. orale, M. fermentans, M. hominis) stammen (Drexler und Uphoff, 2002). Die Hauptquelle für Mykoplasmenverunreinigungen sind heute andere, zuvor mit Mykoplasmen infizierte Zellkulturen, die im gleichen Labor verwendet werden (Rottem & Barile 1993, Drexler et al. 2002; Drexler & Uphoff 2002). Die Infektion kann durch Aerosole, Partikel und unzureichende Zellkulturtechnik direkt - oder indirekt über Medien, Lösungen und Laborgeräte übertragen werden, die bei der Verarbeitung von mykoplasmeninfizierten Zellen durch vorherige Verwendung kontaminiert wurden. Infolgedessen sind 15-35% aller kontinuierlichen Zelllinien mit Mykoplasmen infiziert, aber nur 1% der primären Zellkulturen (Drexler & Uphoff, 2002). Die zweite führende Quelle ist das Laborpersonal, was erklärt, dass Mykoplasmenarten vom Menschen die häufigsten Verunreinigungen (verantwortlich für 40-80% der Infektionen) mit M. orale sind, die üblicherweise die Mundhöhle kolonisieren und die primären Arten darstellen, die aus kontaminierten Zellkulturen isoliert wurden.
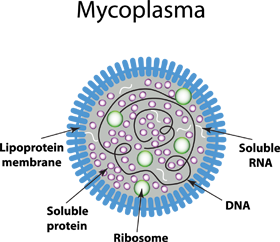
Mykoplasmenarten von Rindern oder Schweinen lassen sich auf kontaminierte Seren und andere tierische Ursprungsprodukte zurückführen, z.B. das weit verbreitete Vorhandensein von A. laidlawii und M. arginini impliziert fetales oder neugeborenes Rinderserum als primäre Infektionsquelle.
Inzwischen sind Seren und Medien selten die Quelle einer Mykoplasmenkontamination (Lincoln & Lundin 1990; Armstrong et al. 2009), solange sie von namhaften Herstellern bezogen werden, die ihre Produkte durch mehrere Filtrationsschritte mit einem 0,1 µm Porenmembranfilter sterilisieren und häufig die Sterilität kontrollieren.
Was macht Mykoplasmenarten schlimmer als andere Bakterienkontaminationen - und warum ist es ein Muss, sie aus Zellkulturen zu verbannen?
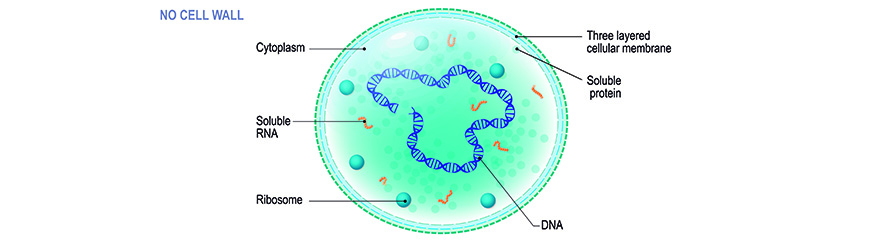
Im Gegensatz zu "gewöhnlichen" Bakterien besitzen diese kleinen Prokaryonten keine Zellwand. Zusammen mit anderen zellwandarmen Bakterien - Arten von Ureaplasma, Acholeplasma, Anaeroplasma, Spiroplasma - bilden sie die Klasse der Mollikuten. Dennoch werden die Begriffe "Mykoplasma" oder früher "pleuropneumonieähnliche Organismen (PPLO)" und "Mollikute" oft gleichbedeutend verwendet. Durch das Fehlen einer Zellwand sind Mykoplasmen immun gegen Antibiotika, die die Peptidoglykanbildung stören, nämlich Beta-Lactam-Antibiotika. Dazu gehören Penicillinderivate, Cephalosporine und Carbapeneme. Darüber hinaus sind sie sehr flexibel in der Form, was sie neben ihrer geringen Größe (je nach Literatur von 0,1 bis 0,8 µm Durchmesser) schwer aus Lösungen zu filtern lässt. Mykoplasmenarten dringen leicht in die Membran von 0,2 µm Filtern ein, die häufig zur Sterilisation von Medien, Seren und anderen in-autoklavierbaren Reagenzien verwendet werden. Die allgemeine Abhängigkeit von komplexen angereicherten Medien (einschließlich Wirtszellnährstoffen) und definierten Umweltbedingungen - beide perfekt in der Zellkultur realisiert - und ihre sehr langsamen Wachstumsraten erschweren die Identifizierung infizierter Zellen mit gängigen mikrobiologischen Kultivierungsmethoden. Durch ihre geringe Größe und fehlende Zellwand können sie hohe Dichten in Zellkulturen erreichen, oft ohne durch Trübung, Zytopathogenität oder gar mikroskopische Untersuchungen nachweisbar zu sein. Die Folgen von Mykoplasmenverunreinigungen sind jedoch nicht zu unterschätzen; weder in Bezug auf die Forschung (und die Karriere des Forschers!) noch in Bezug auf schwerwiegende Gesundheitsrisiken für Mensch und Tier.
Bitte beachten Sie, dass die Mykoplasmenfamilie aus einer Reihe von pathogenen Organismen besteht!
Durch das verdeckte und ungestörte Wachstum in einer Zellkultur kann Mykoplasma die Kontrolle über Reagenzien, Geräte und andere Zelllinien innerhalb weniger Wochen übernehmen (McGarrity 1976). Beachten Sie, dass der Mangel an sichtbaren Effekten ein falsches Sicherheitsgefühl vermittelt: Die anspruchsvollen Organismen verhalten sich auf den ersten Blick oft unauffällig, können aber fast jede einzelne Zellfunktion beeinflussen, von einer verlangsamten Wachstumsrate über metabolische (einschließlich Protein, RNA, DNA-Synthese) bis hin zu morphologischen Veränderungen. Alle diese Effekte basieren hauptsächlich auf einem Wettbewerb um essentielle Nährstoffe (Nukleoside, Nukleotide, Nukleobasen, Arginin und andere Aminosäuren, Fettsäuren, Zucker usw.) und der Freisetzung von toxischen, zytolytischen oder sauren Metaboliten. Durch Auf- und Abregulierung von Zytokinen und Wachstumsfaktoren, Stress-Reaktionsgenen, Transportproteinen, Rezeptoren, Ionenkanälen, Oxidasen, Tumorsuppressoren und Onkogenen verändern Mykoplasmen signifikant die Genexpressionsprofile von kultivierten Zellen (Miller et al. 2003). Deshalb machen sie jedes Experiment mit infizierten Zellen fragwürdig! Darüber hinaus sind sie bekannt dafür, dass sie in vitro chromosomale Aberrationen verursachen, wobei Chromosomenbruch, Translokationsereignisse und die Reduzierung oder Vergrößerung der Chromosomenzahl die häufigsten Ergebnisse sind. Die Virusausbreitung kann auch in beide Richtungen positiv (durch Hemmung der Interferoninduktion und -aktivität) und negativ (durch Konkurrenz um essentielle Nährstoffe) beeinflusst werden. Auch wenn es eine Vielzahl von in der Literatur beschriebenen möglichen Effekten gibt, ist es unvorhersehbar, welcher Effekt auftreten wird. Mögliche Effekte hängen von der Art und dem Stamm der Mykoplasmen, dem infizierten Zelltyp und nicht zuletzt von den Umweltbedingungen ab (Rottem & Barile 1993).

Schließlich sind neben Sicherheitsaspekten die Folgen der Mykoplasmenkontamination im Labor Zeit-, Arbeits- und Geldverlust (in Bezug auf Zellen, Medien, Materialien, aber auch wertvolle Biopharmazeutika, wenn Kulturen zur Herstellung von Impfstoffen, Antikörpern oder Medikamenten verwendet wurden) und der gute Ruf. Die Forschung auf der Grundlage von mykoplasmenkontaminierten Zelllinien wird zu ungenauen oder fehlerhaften Ergebnissen führen, mit dem Resultat irreführender Publikationen. Betrachten Sie die persönliche Verlegenheit und vielleicht den Imageverlust, wenn sich die veröffentlichten Ergebnisse aufgrund eines Kontaminationsproblems als fehlerhaft erweisen. Und wie unangenehm wird es sein, von einem Kollegen informiert zu werden, dass die Zelllinie, die Sie ihm zur Verfügung gestellt haben, verseucht ist? All diese Faktoren sollten bei der Berechnung des Risikos einer verdeckten Mykoplasmeninfektion überdacht werden, indem Zellkulturen NICHT getestet und durch gute Laborpraxis nicht aktiv verhindert werden.
Zusammenfassend lässt sich sagen, dass eine mykoplasmenfreie Zellkultur DIE VORAUSSETZUNG für die Sicherheit und Reinheit von zellbasierten Produkten und zuverlässige Ergebnisse in wissenschaftlichen Experimenten ist.
Die gute Nachricht: Es ist möglich, das Risiko einer allgemeinen Mykoplasmenkontamination zu minimieren - und schwere Ausbrüche auszuschließen.
Das "Mykoplasmenproblem" ist seit Jahrzehnten bekannt - warum gibt es es denn immer noch?!
Es gibt zwei Hauptgründe, warum Mykoplasmenverunreinigungen noch nicht aus den Zellkulturlabors verbannt wurden: Erstens testet die Hälfte der Forscher ihre Zellkulturen noch nicht auf Mykoplasmen (Ryan 2008) und zweitens besteht die Tendenz, sich auf Antibiotika zu verlassen, anstatt auf gute aseptische Praktiken.
Auch wenn die Experten der Zellkultur der Meinung sind, dass der allgemeine Einsatz von Antibiotika die Schwere der Kontaminationsprobleme erhöhen kann, ist der routinemäßige Einsatz von Antibiotika in Zellkulturlabors nach wie vor weit verbreitet. Vor allem die Mykoplasmenkontaminationsraten sind in Zelllinien, die in antibiotikahaltigem Medium gezüchtet werden, viel höher als in antibiotikafreien Kulturen (Barile 1973). Werden Mikroorganismen, Bakterien oder Pilze versehentlich in ein antibiotikafreies Nährmedium eingebracht, replizieren sie sich ungehemmt und führen bald zu sichtbaren Kontaminationsindikatoren: Trübung, Filamentstrukturen, Farbveränderungen durch pH-Veränderung. Im Gegensatz dazu verhindert das Vorhandensein von Antibiotika das mikrobielle Wachstum - vielleicht.
Leider gibt es keine absolute Garantie dafür, dass die zugesetzten Antibiotika gegen die eingeführten Mikroorganismen (wahrscheinlich eine Mischung aus verschiedenen Arten) wirken, und früher oder später wird der Anwender mit einer Art Resistenzerscheinung konfrontiert. Wenn der eingeführte Keim vollständig resistent gegen das Antibiotikum ist, wird er hoffentlich schnell die Kultur überwachsen und innerhalb kurzer Zeit sichtbar werden. Wenn der eingeführte Mikroorganismus nur eine Teilresistenz aufweist, ist die Situation noch schlimmer. Aufgrund des latenten statischen Niveaus von teilweise resistenten Verunreinigungen ist das Risiko von Kreuzkontaminationen und der Verwendung der betroffenen Kultur in Experimenten oder Bioproduktionen nicht zu unterschätzen. Dieser Worst-Case ist sehr wahrscheinlich, wenn der Eindringling zu den Mykoplasmen gehört (z.B. durch Aerosoltröpfchen aus dem Mund des Laboramitarbeiters in die Kultur eingebracht), da die meisten in der Zellkultur verwendeten Antibiotika nicht auf Mykoplasmen wirken! Neben der ohnehin schon unwirksamen Wirkung der Beta-Lactame wurden hohe Resistenzniveaus von Mykoplasmen gegen Streptomycin (88%), Kanamycin (73%), Gentamicin (80%) und Neomycin (86%) (Lundin & Lincoln 1994) bestimmt.
Neben Bariles Beobachtung stark erhöhter Mykoplasmenbelastung sind morphologische und funktionelle Veränderungen weitere Nachteile, die man bei der routinemäßigen Anwendung von Antibiotika berücksichtigen muss (Kuhlmann 1996). Dennoch gibt es nützliche Anwendungen für Antibiotika in der Zellkultur, z.B. innerhalb der ersten zwei Wochen der Primärkultur. Um keine neuen Resistenzen durch Inaktivierung des Antibiotikums zu erzeugen, sollte das antibiotikahaltige Medium regelmäßig erneuert werden.
Referenzen
- Armstrong SE, Mariano JA and Lundin DJ (2010) The Scope of Mycoplasma Contamination within the Biopharmaceutical Industry. Biologicals 38: 211-213.
- Barile MF, Hopps HE, Grabowski MW, Riggs DB and Del Giudice RA (1973) The Identification and Sources of Mycoplasmas Isolated from Contaminated Cell Cultures. Ann. NY Acad. Sci. 225:251-264
- Drexler HG and Uphoff CC (2002) Mycoplasma Contamination of Cell Cultures: Incidence, Sources, Effects, Detection, Elimination, Prevention. Cytotechnology 39:75-90.
- Drexler HG, Uphoff CC, DirksWG and MacLeod RAF (2002) Mixups and mycoplasma: The enemies within. Leukemia Res 26:329–333.
- Kuhlmann I (1996) The Prophylactic Use of Antibiotics in Cell Culture. Cytotechnology 19: 95-105.
- Lincoln CK and Lundin DJ (1990) Mycoplasma Detection and Control. United States Federation for Culture Collection Newsletter 20 (4):1-3.
- Lundin DJ and Lincoln CK (1994) Mycoplasmal Contamination of Cell Cultures within the Clinical Diagnostic Laboratory. Amer. Clin. Lab. April (4):6
- McGarrity GJ (1976) Spread and Control of Mycoplasmal Infection of Cell Cultures. In Vitro 12:643-647.
- Miller CJ, Kassem HS, Pepper SD, Hey Y, Ward TH, Margison GP (2003) Mycoplasma infection significantly alters microarray gene expression profiles. BioTechniques 35:812-814.
- Razin S, Yogev D and Naot Y (1998) Molecular biology and pathogenicity of mycoplasmas. Microbiol Mol Biol Rev 62, 1094-1156.
- Robinson LB, Wichelhausen RH and Roizman B (1956) Contamination of Human Cell Cultures by Pleuropneumonia-like Organisms. Science 124:1147-1148.
- Rottem S and Barile MF (1993) Beware of Mycoplasmas. Trends in Biotechnology 11:143-150.
- Ryan JA (2008) Understanding and Managing Cell Culture Contamination. Corning, Inc. Technical Bulletin
