Biochemische Prozesse werden durch bereits geringe Veränderungen in der Konzentration der freien H+ Ionen deutlich beeinträchtigt.
Daher ist es in der Regel erforderlich, die H+ Konzentration in vitro zu stabilisieren, ohne die Funktion des Systems zu beeinträchtigen. Ein Puffer hält den pH-Wert einer Lösung konstant, indem er Protonen aufnimmt, die während der Reaktionen freigesetzt werden, oder indem er Protonen freisetzt, wenn sie von Reaktionen verbraucht werden. Die Beobachtung, dass teilweise neutralisierte Lösungen schwacher Säuren oder Basen gegen pH-Veränderungen resistent sind, wenn kleine Mengen starker Säuren oder Basen zugegeben werden, führte zum Konzept des "Puffers". In der Tabelle sind die gängigsten biologischen Puffer nach ihrem optimalen Pufferbereich aufgelistet. Die Tabelle gibt auch Hinweise auf mögliche Anwendungen und zeigt Vor- oder Nachteile der aufgeführten Puffersubstanzen.
Die in der Literatur beschriebenen Puffersysteme werden üblicherweise für Experimente verwendet, um einen direkten Vergleich der Ergebnisse zu ermöglichen.
Immer wieder zeigt sich, dass die Bedingungen in Experimenten - auch in Standardsystemen - optimiert werden konnten. In unserem InfoPoint "Biologische Puffer" stellen wir Ihnen eine Auswahl wichtiger Informationen aus der Literatur vor, die Ihnen bei der Lösung Ihrer Alltagsprobleme helfen können und geben Empfehlungen für die Entwicklung und Optimierung Ihrer Testsysteme: Welche Anforderungen müssen biologische Puffer erfüllen? Welche Kriterien sind zu berücksichtigen? Wie wird der pH-Wert effektiv eingestellt?
Biologische Puffer - Übersicht
| Prod. Nr. | Berschreibung | pKs | useful pH range | dpKa/dT# | Kommentar |
| (100mM, 25°C) | |||||
| A1067 | Glycin 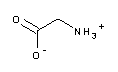 |
pK1=2.35 | 2.2 - 3.6 | Bestandteil des Laemmli-Puffers (A1415) für die SDS-PAGE von Proteinen; stört Protein-Assays nach Lowry (>1mM) und Bradford (>100mM); erhältlich in verschiedenen Qualitäten, z.B. in "molecular biology grade". | |
| A1045 | 4.76 | 3.7 - 5.6 | 0.002 | Natriumsalz der Essigsäure (e.g. A3701, Essigsäure 100%). Wird oft zusammen mit Ethanol zur Fällung von Nukleinsäuren verwendet. | |
| Acetat |
Wir bieten eine Auswahl an verschiedenen Natrium-, Kalium- und Magnesiumqualitäten an; viele dieser Produkte sind auch in Lösung erhältlich. |
||||
| 131457 | 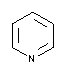 |
5.23 | 4.9 - 5.9 | 0.014 | Nicht autoklavieren! |
| Pyridin | |||||
| A1074 | MES | 6.10 | 5.5 - 6.7 | -0.011 | Zwitterionischer "Good buffer"; Ersatz für Kakodylsäure. Wird in Kulturmedien für Pflanzenzellen verwendet; wird nicht von Bakterien und eukaryotischen Zellen verstoffwechselt. Beeinträchtigt den Protein-Assay nach Lowry, aber nicht den BCA-Test. Wir bieten auch Kaliumsalz sowie alternative Qualitätssorten an. |
| A1351 | Citrat | pK3=6.40 | 5.5 - 7.2 | 0.0 | Tri-Natriumsalz der Zitronensäure. Bindet mehrere Proteine und bildet Komplexe mit Metallionen; stört Proteinassays nach Lowry (>2,5mM), Bradford (>50mM) und mit dem BCA-Test (<1mM). |
| Der pH-Bereich wird durch Mischen von Zitronensäure und Natriumcitrat eingestellt. Beide Produkte sind in verschiedenen Qualitätsstufen erhältlich. | |||||
| A1025 | 6.46 | 5.8 - 7.2 | -0.017 | Wichtiger Puffer für Protein- und Nukleinsäure-Systeme. Wird als Ersatz für Kakodylsäurepuffersysteme in der IEF- und 2D-Gelelektrophorese eingesetzt. Beeinträchtigt den BCA-Test. Auch in " Molekularbiologie-Qualität " erhältlich: A3992 | |
| Bis-Tris | |||||
| A1046 | Phosphat | pK2=7.20 | 5.8 - 8.0 | -0.0028 |
Di-Natriumhydrogenphosphat; Substrat/Hemmer verschiedener Enzyme; präzipitiert zweiwertige Kationen; pKs steigt bei Verdünnung, ist aber nur geringfügig temperaturabhängig. |
| (Hydrogenphosphat) | PBS (phosphatgepufferte Kochsalzlösung, erhältlich als Tablette, z.B. A9201) wird in der Biochemie, Mikrobiologie, Immunologie und Zellbiologie eingesetzt. | ||||
| Beeinträchtigt den BCA- und Lowry-Assay bei Konzentrationen >250mM. Auch als Diammonium- oder Di-Kaliumsalz (A1042) sowie in alternativen Qualitäten erhältlich. | |||||
| A1079 | PIPES | 6.76 | 6.1 - 7.5 | -0.0085 | Zwitterionischer "Good buffer“. Beeinträchtigt den Protein-Assay nach Lowry. Kann Radikale bilden, nicht geeignet für Redoxstudien.) |
| A1060 | ACES | 6.78 | 6.1 - 7.5 | -0.020 | Zwitterionischer "Good buffer“; bindet Cu2+-Ionen und stört den Lowry-Assay. Signifikante Absorption bei 230 nm. |
| A1073 | Imidazol | 6.95 | 6.2 - 7.8 | -0.020 |
'His-tag' gebundene rekombinante Proteine werden durch Nickel-NTA-Säulen effektiv gereinigt. Die gebundenen Proteine können durch Imidazol eluiert werden, das mit dem his-getaggten Protein um die Nickelionen konkurriert. Darüber hinaus wird Imidazol als Puffersubstanz für enzymatische Reaktionen oder zur DNA-Denaturierung eingesetzt. Eine Konzentration von 1 M reduziert die Schmelztemperatur der DNA um ca. 13°C und verändert die Mobilität in der Gelelektrophorese. |
|
Vorsicht: DEPC reagiert mit der nicht-tonierten Form von Imidazol zu N-Carbethoxyimidazol. |
|||||
| Das Produkt ist in verschiedenen Qualitätsstufen erhältlich, z.B. in Molekularbiologie-Qualität A1378. | |||||
| A1062 | 7.09 | 6.4 - 7.8 | -0.016 | Zwitterionischer "Good buffer“; bindet Cu2+-Ionen und stört den Lowry-Assay. | |
| BES | |||||
| A1076 | MOPS | 7.14 | 6.5 - 7.9 | -0.011 | Zwitterionischer "Good buffer“ mit geringer Ionenbindung. Beeinträchtigt den Lowry-Assay. |
| Auch erhältlich in Molekularbiologie-Qualität (A2947). | |||||
| A1084 | 7.40 | 6.8 - 8.2 | -0.020 |
Zwitterionischer "Good buffer“. Beeinträchtigt den Protein-Assay nach Lowry, aber nicht den BCA-Test. |
|
| TES | |||||
| A1069 | HEPES | 7.48 | 6.8 - 8.2 | -0.014 | Zwitterionischer "Good buffer“; weit verbreiteter Puffer in biologischen Studien. In Zellkulturmedien wird es als Ersatz oder Ergänzung für den Bikarbonatpuffer eingesetzt. |
| Beeinträchtigt den Protein-Assay nach Lowry, aber nicht den BCA- und Bradford-Assay. HEPES bindet keine Metallionen, kann aber Radikale bilden und ist nicht für Redoxstudien geeignet. Das Produkt ist in verschiedenen Qualitätsstufen als sterile 1M-Lösung pH 7,5 (A6916) oder pH 8 (A6906) erhältlich. | |||||
| A1072 | HEPPSO | 7.85 | 7.1 - 8.5 | -0.010 | Bindet Cu2+-Ionen; stört den Lowry-Assay, ist aber mit dem BCA-Test kompatibel. Kann Radikale bilden und ist nicht für Redoxstudien geeignet. |
| A1085 | Tricin | 8.05 | 7.4 - 8.8 | -0.021 |
Zwitterionischer "Good buffer“; kann Tris in vielen Puffersystemen ersetzen. Der Austausch von Tricin gegen Glycin im Puffer für SDS-PAGE verbessert die Auflösung im Bereich von 1 - 100 kDa. Tricin bindet zweiwertige Ionen - insbesondere Cu2+- und stört den Lowry- und BCA-Assay. Photooxidiert durch Flavine. |
| A1379 | Tris 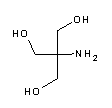 |
8.06 | 7.5 - 9.0 | -0.028 | Tris-Basis. Der am häufigsten verwendete Puffer in der biologischen Forschung. Wichtigste Anwendungen: Elektrophoresepuffer TBE (z.B. A0972), TAE (z.B. A4227) und Laemmli Puffer (A1415), DNA-stabilisierender TE Puffer (z.B.. pH 8, A0973), TBS-Puffer für Western Blots und ELISA. Der pH-Wert ist stark temperaturabhängig und sinkt mit der Verdünnung. Tris ist ein primäres Amin und kann Schiffsche Basen mit Aldehyden/Ketonen bilden. Es inaktiviert DEPC und ist an einigen enzymatischen Reaktionen (z.B. alkalische Phosphatase) beteiligt. Bitte beachten Sie, dass Tris für Säugetierzellen giftig ist und nicht in der Zellkultur verwendet werden sollte. |
| Wir liefern Tris in verschiedenen Qualitätsstufen, als 1M-Lösung mit definiertem pH-Wert sowie als Hydrochlorid (z.B. A1087). | |||||
| A1071 | 8.00 | 7.6 - 8.6 | -0.015 | Ähnliche Eigenschaften wie HEPES. Durch einen hohen Pufferbereich geeignet für Photophosphorylierungsstudien, insbesondere wenn Tricin (bindet Metallionen!) nicht eingesetzt werden kann. Beeinträchtigt den Protein-Assay nach Lowry, aber nicht den BCA-Test. Kann Radikale bilden und ist nicht für Redoxstudien geeignet. | |
| HEPPS | |||||
| A1024 | Bicin | 8.26 | 7.6 - 9.0 | -0,018 | Zwitterionischer, vielseitiger "Good buffer“; wird in Puffern für Enzymreaktionen und Elektrophorese eingesetzt. Geeignet für Tieftemperaturanwendungen. Starke Bindung von Cu2+-Ionen; stört den BCA- und Lowry-Protein-Assay. Ferricyanid oxidiert langsam das Bicin. |
| A1141 | Taurin (AES) | 9.06 | 8.4 - 9.6 | -0.022 | Zwitterionischer Puffer. |
| A1065 | CHES | 9.50 | 8.6 - 10.0 | -0.011 | Geeignet zur Kristallisation von Phosphotriesterase oder zur chemischen Modifikation von Bacteriorhodopsin. Beeinträchtigt den Protein-Assay nach Lowry. |
| A0838 | AMP | 9.69 | 8.7 - 10.4 | -0.032 | Gut geeignet zur Bestimmung der Enzymaktivität, insbesondere der alkalischen Phosphatase, Laktat- und Malatdehydrogenase. |
| AMP hat einen niedrigen Schmelzpunkt und muss bei ca. 35°C verflüssigt werden, um eine Pufferlösung herzustellen. Das verflüssigte AMP hat eine hohe Viskosität, was die Handhabung erschwert. Wird diese Pufferlösung bei Raumtemperatur gelagert und vor dem CO2 aus der Luft geschützt, ist sie ca. einen Monat haltbar.. | |||||
| A1067 | Glycin 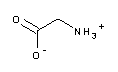 |
pK2=9.78 | 8.8 - 10.6 | -0.025 | Bestandteil des Laemmli-Puffers (A1415) für die SDS-PAGE von Proteinen; stört Protein-Assays nach Lowry (>1mM) und Bradford (>100mM). |
| A3900 | Karbonat | pK2=10.33 | 9.5 - 11.1 | -0.009 | Natriumkarbonat |
| A1046 | Phosphat | pK3=12.33 | -0.026 | Di-Natriumhydrogenphosphat | |
| (Hydrogenphosphat) |
Legende
# Änderungen des pK-Wertes pro Grad Celsius
§ 5 % CO2-Atmosphäre
Daten teilweise aus Bollag, D.M. & Edelstein, S.J. (1992) Proteinmethoden, Kapitel 1, II (S. 3-9). Wiley-Liss, New York.
Requirements of biological buffers
Ursprünglich wurden verschiedene anorganische Substanzen als Puffer verwendet, z.B. Phosphat, Cacodylat, Borat und Bicarbonat. Später wurden auch schwache organische Säuren verwendet. Viele dieser Puffersubstanzen haben jedoch den Nachteil, dass sie nicht inert sind und dauerhafte Auswirkungen auf das zu untersuchende System haben (z.B. Hemmung von Enzymen, Wechselwirkungen mit Enzymsubstraten etc.). Die meisten der heute verwendeten biologischen Puffer wurden von NE Good und seinem Forschungsteam entwickelt und sind N-substituierte Taurin- oder Glycinpuffer. Diese zwitterionischen Substanzen erfüllen weitgehend die Anforderungen oder Eigenschaften, die für biologische Anwendungen erforderlich sind.
-

Löslichkeit
Der Puffer sollte in Wasser frei löslich und in anderen Lösungsmitteln schwer löslich sein. Je höher die Wasserlöslichkeit, desto einfacher ist es, konzentrierte Stammlösungen herzustellen.
-

Durchlässigkeit
Der Puffer sollte nicht in der Lage sein, biologische Membranen zu durchdringen, um eine Aggregation in der Zelle oder den Organellen zu verhindern. Tris hat einen relativ hohen Grad an
Fettlöslichkeit und kann daher Membranen durchdringen. Dies erklärt auch seine Toxizität für viele Säugetierzellen in der Kultur. -

Ionenstärke
Der Puffer sollte die Ionenstärke des Systems nicht wesentlich verändern. Die physiologische Ionenstärke liegt zwischen 100 - 200 mM KCl oder NaCl. Dies kann besonders bei der Untersuchung von enzymatischen Reaktionen sehr wichtig sein, da die Ionenstärke der Lösung ein Maß für das ionische Milieu ist, das auch die katalytische Aktivität eines Enzyms beeinflussen kann. Die Protonisierung und Deprotonierung in Abhängigkeit von der ionischen Zusammensetzung des umgebenden Mediums im Reaktionsaufbau beeinflusst die Bindung und Umwandlung eines Enzymsubstrats durch das Enzym.
-

pKs-Wert
Der pKs-Wert eines Puffers sollte durch die Pufferkonzentration, die Temperatur und die Ionenzusammensetzung des Mediums so wenig wie möglich beeinflusst werden. Zu den Puffern mit temperaturabhängigen pKsWerten gehören die Aminpuffer, während Carbonsäurepuffer im Allgemeinen weniger empfindlich auf Temperaturänderungen reagieren.
-

Komplexbildung
Wenn ein Puffer mit Metallionen Komplexe bildet, werden Protonen freigesetzt, wodurch der pH-Wert sinkt. Ein größeres Problem stellt jedoch in der Regel die Bildung unlöslicher Fällungen dar. Wenn Enzyme die Metallionen für ihre Aktivität benötigen, werden diese gehemmt. Komplexe sollten daher löslich sein und ihre Bindungskonstante bekannt sein. Phosphate bilden beispielsweise mit bivalenten Metallen unlösliche Salze und präzipitieren. Phosphatgepufferte Salzlösung (PBS) wird daher niemals mit Ca2+ oder Mg2+ autoklaviert. "Good buffers“ wie PIPES, TES, HEPES und CAPS haben sehr niedrige Metallbindungskonstanten und eignen sich daher besonders für die Untersuchung metallabhängiger Enzyme.
-

Inerte Stoffe
Der Puffer sollte weder enzymatischen noch nicht-enzymatischen Veränderungen unterliegen, d.h. er sollte kein Enzymsubstrat oder Enzyminhibitor sein und nicht mit Metaboliten oder anderen Komponenten reagieren. Der Puffer sollte daher inert sein. Phosphat und Pyrophosphat sind sowohl Substrate als auch Inhibitoren verschiedener enzymatischer Reaktionen (Hemmung von Carboxypeptidase, Urease, verschiedenen Kinasen, verschiedenen Dehydrogenasen). Borat bildet kovalente Komplexe mit Mono- und Oligosacchariden, Ribose-Untereinheiten von Nukleinsäuren, Glycerin und Pyridinnukleotiden. Bicarbonat befindet sich im Gleichgewicht mit CO2 und benötigt daher ein geschlossenes System. Tris und andere primäre Amine wie Glycin können Schiffsche Basen mit Aldehyden und Ketonen bilden. Sie stören auch den Bradford-Protein-Assay. Tricin wird durch Flavine photooxidiert, und Tageslicht reicht daher aus, um die Aktivität von Flavonenzymen zu reduzieren. HEPES, HEPPS und Bicin stören die Lowry-Protein-Assays. Puffer, die chemisch auf dem Piperazinring basieren, können unter Umständen Radikale bilden.
-

UV-Absorption
Puffer sollten bei Wellenlängen über 230 nm kein Licht absorbieren, da in diesem Bereich viele spektrophotometrische Untersuchungen durchgeführt werden (Bestimmung der Konzentrationen von DNA, RNA und Proteinen). ADA zum Beispiel hat eine Absorption von 0,1 bei 260 nm. Wenn Puffer die photometrischen Analysen stören, sollten sie neutralisiert oder auf das für das verwendete Testsystem optimale pH-Wert eingestellt werden (Lowry pH 10; BCA pH 11; Bradford pH 1; kolloidales Gold pH 3). Ist dies nicht möglich, können Proteine beispielsweise mit Trichloressigsäure, Perchlorsäure oder Aceton ausgefällt und dann in einem nicht störenden Lösungsmittel wieder aufgelöst werden.
Kriterien für die Auswahl
Auswahl des Puffers für den richtigen pH-Bereich
Der pKs-Wert des Puffers sollte im Bereich des pH-Optimums für das Testsystem liegen. Wenn der pH-Wert während des Experiments wahrscheinlich ansteigen wird, sollte ein Puffer mit einem pKs-Wert gewählt werden, der etwas höher ist als das Optimum zu Beginn des Experiments. Umgekehrt, wenn der pH-Wert während des Experiments voraussichtlich abnimmt, sollte ein Puffer mit einem etwas niedrigeren pKs-Wert gewählt werden.
Bestimmung des pH-Optimums eines Enzyms
Wenn ein Enzym untersucht werden soll, ist der erste Schritt in der Regel die Bestimmung der Bedingungen, unter denen das Enzym ein Höchstmaß an Stabilität und Aktivität aufweist. Zur Bestimmung des pH-Optimums empfiehlt es sich, zunächst Puffer zu verwenden, die ein breites pH-Spektrum abdecken, z.B. MES, PIPES, HEPES, TAPS, CHES und CAPS. Nach Identifizierung des pH-Optimums können andere Puffer (z.B. für den pH-Wert 7,5: TES, TEA oder Phosphat) getestet werden, um unspezifische Pufferwirkungen für spätere Untersuchungen ausschließen oder minimieren zu können. Der pKs-Wert eines Puffers, d.h. der Mittelpunkt seines pH-Bereichs, sollte so nah wie möglich am gewünschten pH-Wert für den verwendeten Puffer liegen. Mit anderen Worten, der pKssollte dem pH-Optimum des zu testenden Enzyms entsprechen. Die protonierten (ionisierten) Formen von Aminpuffern haben weniger hemmende Wirkungen als die nicht-protonierten Formen. Für Tris und zwitterionische Puffer ist daher in der Regel ein Arbeitsbereich etwas niedriger als der pKs-Wert besser geeignet, während im Gegensatz dazu Carbonsäurepuffer mit einem Arbeitsbereich leicht über ihren pKs-Werten besser geeignet sind, da diese Puffer hauptsächlich aus der ionisierten Form bestehen.
Bestimmung der optimalen Pufferkonzentration
Eine ausreichende Pufferkapazität wird oft erst bei Konzentrationen über 25 mM erreicht. Höhere Pufferkonzentrationen und damit verbundene hohe Ionenstärken können jedoch die Enzymaktivität hemmen. Geeignete Anfangskonzentrationen liegen daher zwischen 10 und 25 mM. Ändert sich nach Zugabe des Proteins oder Enzyms der pH-Wert um mehr als 0,05 Einheiten, kann zunächst die Konzentration des Puffers auf 50 mM erhöht werden. Bis zu dieser Konzentration wurde bei Zellkulturexperimenten keine Interferenz mit den "Good buffers“ beobachtet. Um Komplexe mit Schwermetallen zu bilden, kann EDTA zugesetzt werden.
Anwendungsabhängige Auswahl der Puffersubstanzen
Die Entscheidung für oder gegen einen Puffer ist auch abhängig von der Methode, für die er verwendet wird. Neben der Aktivitätsmessung wird die Proteinkonzentration in der Regel nach Isolations- oder Reinigungsprozessen bestimmt. Viele der auf Aminosäuren basierenden Puffersubstanzen können bei Protein-Assays (z.B. Lowry) aufgrund von Wechselwirkungen mit den Reagenzien oder der Absorption der Puffersubstanz selbst im Bereich über 230 nm zu falsch-positiven Ergebnissen führen. Diese Störungen können jedoch durch die Einbindung des Puffers in die Leerwertkontrolle od. Negativkontrolle leicht beseitigt werden.
Viele Puffer sind grundsätzlich für die Gelfiltration geeignet. Kationische Puffer wie Tris werden für die Anionenaustauschchromatographie bevorzugt. Anionische Puffer (wie Phosphat oder MES) sind für die Kationenaustauschchromatographie oder Hydroxylapatit-Chromatographie zu bevorzugen, d.h. der Puffer sollte die gleiche Ladung wie das Ionenaustauschermaterial aufweisen, um zu verhindern, dass es sich selbst an den Ionenaustauscher bindet.
Borat ist nicht für die Isolierung von Glykoproteinen oder Systemen mit Nukleotiden geeignet, da es mit der cis-Hydroxylgruppe von Zuckern interagiert. Wird die Elektrophorese nach der Auflösung des Proteins in Proteinreinigungssystemen durchgeführt, sollte ein Puffer mit geringer Ionenstärke verwendet werden, da eine hohe Ionenstärke das Gel erwärmen würde.
Die "Good buffers“ auf Basis des Piperazinrings - HEPES, HEPPS, HEPPSO und PIPES - sind nicht für die Untersuchung von Redoxprozessen geeignet, da sie in Gegenwart von H2O2 Sauerstoffradikale, autooxidierendes Eisen oder unter bestimmten elektrolytischen Bedingungen leicht Radikale bilden. Im Gegensatz dazu bildet der "Good buffer“ auf Basis eines Morpholinrings, MES, keine Radikale.
Einstellen des pH-Wertes
Puffer bestehen aus einer Säure und ihrer konjugierten Base. Die Qualität eines Puffers wird durch seine Pufferkapazität bestimmt, d.h. seine Beständigkeit gegen pH-Veränderungen bei Zugabe starker Säuren oder Basen. Mit anderen Worten: Die Pufferkapazität entspricht der Menge an H+- oder OH- Ionen, die durch den Puffer neutralisiert werden können. Die Pufferkapazität ist abhängig von der Pufferkonzentration und erreicht ihr Maximum beim pKs -Wert. Dieser Wert entspricht der Mitte des vom Puffer abgedeckten pH-Bereichs (Konzentration von Säure und Base ist gleich). Infolgedessen führen relativ große Mengen an H+/OH- Ionen nur zu geringen pH-Wertänderungen. Ein Puffer mit einem pH-Wert von einer pH-Einheit über oder unter seinem pKs -Wert zeigt keine Pufferkapazität mehr an.
Die Kalibrierung des pH-Wertes ist nicht so einfach, wie es auf den ersten Blick scheint. Es gibt eine Reihe von Fakten, die die Protonenkonzentration beeinflussen und Auswirkung auf die Funktion des Puffers haben:
Säure/ Base: Im Allgemeinen wird der pH-Wert mit NaOH/KOH oder HCl eingestellt. Die langsame Zugabe der Säure oder Base unter starkem Rühren vermeidet lokal hohe Konzentrationen von H+- oder OH-Ionen. Andernfalls können die Puffersubstanzen chemische Veränderungen erfahren, die sie inaktivieren oder so modifizieren, dass sie eine hemmende Wirkung haben. Steht ein Puffer in der protonierten Form (Säure) und der nicht-protonierten Form (Base) zur Verfügung, wird empfohlen, den pH-Wert durch Mischen der beiden Substanzen einzustellen.
Wenn einwertige Kationen die Reaktion stören oder untersucht werden sollen, kann der pH-Wert mit Tetramethyl oder Tetraethylammoniumhydroxid eingestellt werden. Anstelle von HCl kann auch Acetat, Sulfat oder Glutamat verwendet werden, wobei hier das Risiko einer Interferenz mit einem Enzym besonders hoch ist.
Temperatur: Je nach Puffersubstanz kann der pH-Wert je nach Temperatur variieren. Es ist daher ratsam, den pH-Wert auf die später verwendete Betriebstemperatur einzustellen. Der physiologische pH-Wert der meisten tierischen Zellen bei 37°C liegt zwischen 7,0 und 7,5. Ein Puffer, der besonders anfällig für Temperaturschwankungen ist, ist Tris. Bei Einstellung auf 7,5 bei 37°C steigt er auf etwa 8,5 bei 0°C. "Good buffers“ haben in der Regel eine geringe Temperaturempfindlichkeit, und Carbonsäurepuffer (Citrat, Formiat, Succinat) sind noch weniger empfindlich.
Heutzutage haben viele pH-Meter eine integrierte Funktion, die es ermöglicht, den pH-Wert bei Raumtemperatur einzustellen und unterschiedliche Arbeitstemperaturen (z.B. +4°C oder +37°C) zuzulassen. Eine Einschränkung dieser Funktion ist jedoch, dass der dpKa/dT-Wert, d.h. der Wert für die Änderung des pKs -Wertes (dpKa) in Abhängigkeit von der Temperaturänderung (dT), nicht für alle Puffer gleich ist. So beträgt beispielsweise die Änderung des pKs -Wertes für Tris bei einer Erhöhung um 1°C 0,028 Einheiten, während sich der Wert für HEPES nur um 0,014 ändert. Ungenauigkeiten sind bei diesem Ansatz unvermeidlich, da solche Veränderungen eigentlich mit dem pH-Meter berücksichtigt werden sollten.
Pufferadditive: Werden dem Puffer weitere Komponenten zugegeben (z.B. EDTA, DTT, Mg2+), sind auch Veränderungen des pH-Wertes zu erwarten und erneut zu testen.
Ionenstärke: Die Einstellung der Ionenstärke einer Pufferlösung (falls erforderlich) sollte in gleicher Weise erfolgen wie die Einstellung des pH-Wertes bei der Auswahl des Elektrolyten. Die Ionenstärke ist abhängig vom Elektrolyten. Die Salze von Tetramethylammonium oder Tetraethylammonium eignen sich zur Einstellung der Ionenstärke, da die größeren Kationen nicht so gut mit den negativen Ladungen der Enzyme interagieren. Acetat, als großes Anion, hat eine schlechte Wechselwirkung mit den Alkalimetallen.
Kontrolle des pH-Meters: Für die Einstellung des pH-Wertes eines Puffers stehen heute meist genaue pH-Meter mit Digitalanzeige zur Verfügung. Das pH-Meter wird mit zwei pH-Standards kalibriert, die den Bereich des einzustellenden Puffers abdecken. Bestehen Zweifel an der Genauigkeit des Gerätes, kann dies einfach durch eine Standardisierung des pH-Meters mit 50 mM Phosphatpuffer gelöst werden, der dann 10fach verdünnt wird. Der pH-Wert sollte dann um 0,2 pH-Einheiten höher sein.